
科目: 来源: 题型:
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:

Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 ,
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
。
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是
Ⅱ.有同学提出,还可以采用以下方法来测定:

(1)溶解样品改用了硫酸,而不用盐酸,为什么
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是:
(3)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数,下列说法不正确 的是
A.2g氢气所含分子数目为NA
B.在标准状况下,NA个水分子所占有的体积约为22.4 L
C.18g水中含有的电子数为10NA
D.1L 0.3mol·L-1Na2SO4溶液中,含有Na+和SO42- 总数为0.6NA
查看答案和解析>>
科目: 来源: 题型:
中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。
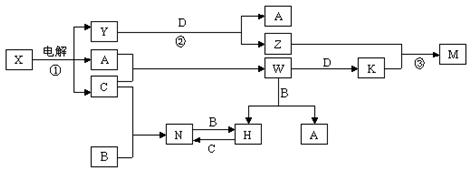
已知:A、B、C、D是单质,其余是化合物。其中B、D是常见金属,且组成B的元素属于过渡元素。又知A在C中点燃有苍白色火焰,M既可溶于盐酸又可溶于NaOH溶液。请回答下列问题:
(1)W的电子式是_______________。
(2)写出N的化学式 。
(3)写出下列反应的离子方程式:
反应① ,
反应③__________________________________________________________,
K溶液和过量氨水反应____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
将3.9g镁铝合金,投入到500mL2mol·L-1的盐酸中,金属完全溶解,再加入4mol·L-1
的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是
A.125mL B.200mL C.250mL D.560mL
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z三种常见的短周期元素可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多一个电子层。试回答:
(1)写出X、Y、Z三种元素的符号和名称: ;
(2)分析Z2Y2中含有的化学键类型: ;
(3)写出Z2Y2与二氧化碳反应的方程式: ;
(4)用电子式表示X和Z两元素形成化合物的过程: 。
查看答案和解析>>
科目: 来源: 题型:
下列措施不符合节能减排的是
A.大力发展火力发电,解决广东电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,用做家庭燃气
查看答案和解析>>
科目: 来源: 题型:
若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是
A.b=a-n-m B.离子半径Am+<Bn-
C.原子半径A<B D.A的原子序数比B大(m+n)
查看答案和解析>>
科目: 来源: 题型:阅读理解
(1)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。目前中学课本中的酸碱理论是1889年阿仑尼乌斯(Arrhenius)提出的电离理论。
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱。试写出液氨自身电离的方程式: 。
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论。凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是 。
A、H2O B、NH4+ C、OH- D、HCO3- E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念。凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸。
酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O。
试指出下列两个反应中的酸或碱:
(Ⅰ)H3BO3 +H2O ![]() H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O);
H++B(OH)4-,该反应中的碱是 (填H3BO3或H2O);
(Ⅱ)NaH+H2O ==NaOH+H2↑,该反应中的酸是 (填NaH 或H2O)。
(2)已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满。D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1。按要求填写
① B的电子排布式是: ,A、B两元素形成的化合物的晶体类型是 。
②D元素单质的晶体类型是 ,C单质的制备方法是: 。
③E和F形成的化合物空间构型为 ,该物质比D与E形成的化合物更容易液化的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com