
科目: 来源: 题型:
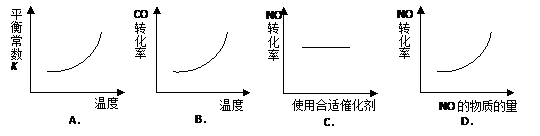
汽车尾气净化中的一个反应如下:
NO(g)+CO(g)![]()
![]() N2(g)+CO2(g) △H=-373.4kJ·mol-1
N2(g)+CO2(g) △H=-373.4kJ·mol-1
在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是
查看答案和解析>>
科目: 来源: 题型:
我国经济发展对能源的需求与日俱增。一种新型燃料电池是将两根特制电极插入氢氧化钾溶液中,然后从两极分别通入甲烷和氧气,其电极反应式为:
X极:CH4+10OH- -8e- == CO32-+7H2O Y极:4H2O+2O2+8e- ==8OH-
( 1)、指出该电池的正极__________(X极或Y极)
(2)、在标准状况下,通入5.6L甲烷气体,完全反应后有__________mol电子转移;
(3)、该电池的电解质溶液的PH变化是__________(填升高、降低、不变)
查看答案和解析>>
科目: 来源: 题型:
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= - A kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= - B kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= + C kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式:
查看答案和解析>>
科目: 来源: 题型:
已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2;NaCN+HF==HCN+NaF ; NaNO2+HF==HNO2+NaF ;由此可判断下列叙述中正确的是
A. HF的电离常数是① B. HNO2的电离常数是①
C. HCN的电离常数是② D. HNO2的电离常数是③
查看答案和解析>>
科目: 来源: 题型:
铜板上铁铆钉处的吸氧腐蚀原理如下图所示,下列有关说法中,不正确的是
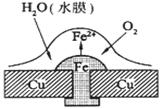
A.正极电极反应式为:2H++2e- → H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z三种元素,X与氢气能形成气态XH4,其中X的质量分数为75%,且X与Y能形成XY2型化合物。Y的价电子构型为msmmpn,且p轨道上仅有一对孤对电子。Z的最高价氧化物的水化物是酸性最强的酸。
(1)X元素所形成的同素异形体中硬度最大的是 (填名称)
(2)Y的氢化物分子的空间构型 ,熔化时克服的作用力是 和
(3)Z元素位于周期表第 周期第 族,它的氢化物是 (填“极性”或“非极性”)分子。
(4)X与Z形成的化合物其分子的空间构型是 电子式
查看答案和解析>>
科目: 来源: 题型:
将一定质量的Al、Fe混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96L;如果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气6.72L。
(1)写出与碱反应涉及的化学方程式:_____________________________________
(2)混合物中Al和Fe的质量分别为________和__________
(3)当混合物与盐酸反应时,转移电子数为_______mol;与NaOH溶液反应时转移电子
数为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com