
科目: 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:+3 2 ,则在电化学合成氨的过程中,阴极反应式为_________;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为 ;
②右图中在状态A时,平衡常数 KA (填写代入数值的表达式,不要求算出具体数值);当温度由T1变化到T2时,KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿佛加德罗常数的值,下列叙述中正确的是( )
A.在标准状况下,完全燃烧2.24L辛烷可生成CO2分子数为0.8NA
B.常温常压下,30g乙酸与30g葡萄糖含有的氧原子数都是NA
C.1mol -OH所含的电子数为17NA
D.1mol Cl2通入足量的NaOH溶液中充分反应转移的电子数为2NA
查看答案和解析>>
科目: 来源: 题型:
当一个可逆反应达到平衡状态后,如果改变________________、_____________、_____________等反应的条件,原来的________________________会被破坏,化学平衡会发生移动。
查看答案和解析>>
科目: 来源: 题型:
已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g) △H= +13.8kJ·mol-1
则下列说法不正确的是 ( )
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
下列说法中错误的是( )
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.需要加热才能发生的反应一定是吸热反应
D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
查看答案和解析>>
科目: 来源: 题型:
下列过程都与热量变化有关,其中表述不正确的是( )
A、CO(g)的燃烧热是283.0KJ/mol,则表示CO(g)燃烧反应的热化学方程式为:
CO(g)+1/2 O2(g)= CO2(g);△H=-283.0KJ/mol
B、稀盐酸和稀氢氧化钠溶液反应的中和热为57.3KJ/mol,则表示稀硫酸与稀氢氧化钡
溶液发生反应的热化学方程式为:H+ (aq) + OH-(aq) = H2O(l);△H=-57.3KJ/mol
C、铝热反应是放热反应,但需要足够的热量才能使反应发生
D、水的电离过程是吸热过程,升高温度,水的离子积增大、PH减小
查看答案和解析>>
科目: 来源: 题型:
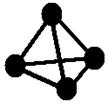 意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1molN—N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1molN—N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是
A.N4属于一种新型的化合物 B.N4晶体熔点高,硬度大
C.相同质量的N4能量高于N2
D.1molN4转变成N2将吸收882kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com