
科目: 来源: 题型:
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池,除氢气外,烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料。请回答下列问题:
(1)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池.写出其正极反应式
。
(2)以上述电池为电源,通过导线与图14电解池相连。
(Ⅰ)X、Y为石墨,a为1L0.1mol/L的氯化钾溶液,写出电解总反应的离子方程式
。
(II)X、Y分别为铁、铜,a为1L0.1mol/L硫酸铜溶液,写出X电极反应式
。
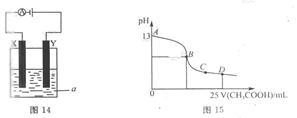
(3)室温时,按(I)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图15(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①结合图15计算消耗标准状况下甲烷 mL。
②若图15的B点pH=7,则酸碱恰好完全反应的点是 区间(填“AB”、“BC”或“CD”)。
③AB区间溶液中各离子浓度大小关系是 。
查看答案和解析>>
科目: 来源: 题型:
将蔗糖水解并用新制的银氨溶液检验其水解产物的实验中,进行的主要操作有:①加热 ②滴入5滴稀硫酸 ③取20%的蔗糖溶液5 mL④加入银氨溶液中 ⑤向混合溶液中加氢氧化钠溶液调pH呈碱性。正确的操作顺序是( )
![]() A、③②⑤④① B、③②④⑤① C、③②①④① D、③②①⑤④①
A、③②⑤④① B、③②④⑤① C、③②①④① D、③②①⑤④①
查看答案和解析>>
科目: 来源: 题型:
在密闭容器内,可逆反应:![]() ,达到平衡状态的标志是:
,达到平衡状态的标志是:
(1)单位时间内生成![]() 的同时生成
的同时生成![]()
(2)单位时间内生成![]() 的同时生成
的同时生成![]()
(3)用![]() 的物质的量浓度变化表示反应速率的比为2:2:1的状态
的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A.(1)(3)(4) 高*考*资*源*网 B.(2)(3)(5)
C.(1)(4)(5) D.(1)(2)(3)(4)(5)
查看答案和解析>>
科目: 来源: 题型:
已知:CH2=CH—CH=CH2 和CH3—CH=CH2分别可以写成:![]() 和
和![]() ;
;
“双烯合成反应”又称为“Diels-Alder反应”,如: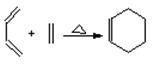 。
。
请回答下列问题:
(1)现有反应: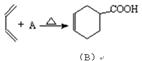 ,则物质A的结构式为: ________________ ;
,则物质A的结构式为: ________________ ;
在浓磷酸作用下,B与乙醇共热生成酯的化学方程式为: _________________________________________________ 。
(2)在反应: 中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为: _____________;将物质E与过量的H2发生加成反应,其生成物的化学式为 _________ 。
中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为: _____________;将物质E与过量的H2发生加成反应,其生成物的化学式为 _________ 。
(3)![]() 和
和![]() 都是无色液体,下列物质中可以用来鉴别这两种物质的是 (填序号):①银氨溶液、②淀粉溶液、③溴水、④酸性KMnO4溶液 ;
都是无色液体,下列物质中可以用来鉴别这两种物质的是 (填序号):①银氨溶液、②淀粉溶液、③溴水、④酸性KMnO4溶液 ;
物质![]() 与物质
与物质![]() 发生“Diels-Alder反应”的生成物为: ___。
发生“Diels-Alder反应”的生成物为: ___。
(4)从现代化学观点看,“Diels-Alder反应”的优点是:__________________________ 。
查看答案和解析>>
科目: 来源: 题型:
随着经济的不断发展,人们对环境问题也越来越关注。
(1)室内空气污染问题得到越来越多的关注,下列物质中也属于室内挥发性有机污染物的是___________________。(填字母)
a.苯 b.甲烷 c.醋酸 d.乙烯
(2)下列措施中,有利于降低室内污染物浓度的是__________。(填字母)
a.勤开窗通风 b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料 d.室内放一些活性碳
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O![]() C6H12O6+6O2 b.CO2 + 3H2
C6H12O6+6O2 b.CO2 + 3H2![]() CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4![]() CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2![]() CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)最高的是 。
(4) “汽车尾气污染”已倍受世人关注。以辛烷(C8H8)代表汽油的成分,要使辛烷正好完全燃烧,则辛烷气与空气(空气中O2占1/5体积)的体积比(相同条件下)为 (保留三位小数)。
查看答案和解析>>
科目: 来源: 题型:
在3升的密闭容器中,充入3molX(g)和2molY(g),在一定条件下发生应:4X(g)+3Y(g) ![]() 2Q(g)+nR(g), 2min内达平衡,此时容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小了1/3。
2Q(g)+nR(g), 2min内达平衡,此时容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小了1/3。
(1)试求n值? (2)2min内Y的反应速率? (3)求达到平衡后Y的转化率?
查看答案和解析>>
科目: 来源: 题型:
下列反应既属于氧化还原反应,又是吸热反应的是 ( )
A.铝片与盐酸的反应 B.灼热的碳与CO2的反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目: 来源: 题型:
氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是
A.35Cl原子所含质子数为18
B.1/18mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5g35Cl2气体的体积约为22.4L
D.35Cl2气体的摩尔质量为70g
查看答案和解析>>
科目: 来源: 题型:
稀土元素(包括钇、钪和镧系等金属元素)是能源、信息等领域的领域的关键材料,我国稀土产量占世界的85%以上。镧(La)镍(Ni)的某种合金可表示为LaNi5,它具有神奇的吸氢能力(最大储氢量达到![]() 个氢原子/cm3),反应如下:LaNi5H6
个氢原子/cm3),反应如下:LaNi5H6![]() LaLi5+3H2,其中固体LaNi5H6具有导电必,被称为金属型氢化物。
LaLi5+3H2,其中固体LaNi5H6具有导电必,被称为金属型氢化物。
试回答:
(1)氢位于周期表的 族,该族元素的金属性随原子序数递增而 ;
(2)对于反应LaNi5H6![]() LaLi5+3H2,保持温度不变,当平衡 (填“正向移动”或“逆向移动”)时,LaNi5的吸氢量会增加。温度升高后,若平衡常数K值变大,平衡 (填“不移动”、“向正向移动”或“向逆向移动”)。LaNi5吸氢的适宜条件是 ;
LaLi5+3H2,保持温度不变,当平衡 (填“正向移动”或“逆向移动”)时,LaNi5的吸氢量会增加。温度升高后,若平衡常数K值变大,平衡 (填“不移动”、“向正向移动”或“向逆向移动”)。LaNi5吸氢的适宜条件是 ;
(3)镍可用于制镉镍电池,但镉元素对环境有污染,为此,人们开发了碱性氢镍电池,它利用LaNi5良好的吸氢能力,用固体NaLi5H6作负极反应物,其中氢元素的化合价为 ,电池放电时,发生氧化反应的电极反应式为 。电池充电时,每转移2mole-,最多形成 cm3LaNi5H6;
(4)已知液态氢的密度为![]() ,则相同体积LaNi5(以最大吸氢量计)和液态氢的含氢量之比为 。
,则相同体积LaNi5(以最大吸氢量计)和液态氢的含氢量之比为 。
查看答案和解析>>
科目: 来源: 题型:
[物质结构与性质]
I . 固体二氧化碳外形似冰,受热汽化无液体产生,俗称“干冰”,根据干冰晶胞结构回答:

(1)干冰中一个分子周围有__________个紧邻分子。
(2)堆积方式与干冰晶胞类型相同的金属有_________(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)CO2中心原子的杂化方式为_______,有一种与CO2互为等电子体的离子,能用于鉴别Fe3+ ,写出其电子式______________________。
II. 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。

(4)写出Cu3+的电子排布式: 。
(5)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为: 。
(6)根据(5)所推出的化合物的组成,(该化合物中各元素的化合价为Y +3、Ba +2),计算该物质中+2价和+3价的Cu离子个数比为:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com