
科目: 来源: 题型:
纳米材料的表面粒子占总粒子的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状与氯化钠晶胞的大小和形状相同,则这种纳米颗粒的表面粒子数与总粒子数的比值为( )
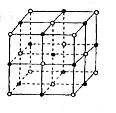
A.7:8 B.13:14 C.25:26 D.26:27
查看答案和解析>>
科目: 来源: 题型:
已知X+、![]() 、Z
、Z![]() 、
、![]() 四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,正确的是
四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,正确的是
A.原子序数:Y>X>Z>W B.原子半径:X>Y>Z>W
C.原子最外层电子数:Y>X>Z>W D.金属性:X<Y,还原性:![]() >
>![]()
查看答案和解析>>
科目: 来源: 题型:
常温下,有甲、乙两份体积均为1 L、浓度均为0.1 mol/L的氨水,其pH为11。①甲 用蒸馏水稀释100倍后,溶液的pH变为a;②乙与等体积、浓度为0.2 mol/L的盐酸 混合,在混合溶液中:n(NH4+ )+n(H+)-n(OH-) = b mol。则a、b正确的答案组合是 ( )
A.9-11之间;0.1 B.9-11之间;0.2
C.12-13之间;0.2 D.13;0.1
查看答案和解析>>
科目: 来源: 题型:
根据相关化学原理,下列判断正确的是
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若A2+2D-→2A-+D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
查看答案和解析>>
科目: 来源: 题型:
将一定质量的Zn放入18mol/L的浓H2SO4中,充分反应后,共收集到标况下的气体4.48L,且1mol该气体的质量为48.5克。在反应后的溶液中,加入足量的BaCl2溶液,生成58.25克的沉淀。则求:
(1)所得气体的成份和各自的体积。
(2)所用Zn的质量。
(3)消耗浓H2SO4的体积为多少毫升(保留小数点一位)。
查看答案和解析>>
科目: 来源: 题型:
下列各组离子能在水溶液中大量共存的是
A.Ca2+、SO42-、H+、HCO3- B.H+、NO3-、Cl-、SiO32-
C.K+、HCO3-、Na+、OH- D. K+、Na+、CO32-、SiO32-
查看答案和解析>>
科目: 来源: 题型:
KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2,另含Al2O3、SiO2杂质)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用铂板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
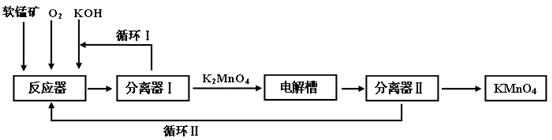
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿会导致KOH消耗量偏高,用离子方程式表示KOH消耗偏高的原因 、
。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式:
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
与传统法相比,液相法的优点是:__ _________。
查看答案和解析>>
科目: 来源: 题型:
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下:镁条、铝条、铝粉、钠、新制的Na2S溶液、新制的氯水、0.5mol/L的盐酸、3mol/L的盐酸、酚酞试液,其设计的实验方案及部分实验现象如下表:
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
请回答下列问题:
(1)实验③的现象是 ,该反应的离子方程式为 ,
(2)由实验③得出的实验结论是
(3)由实验②可得出决定化学反应快慢的主要因素是
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确? (填是或否)
(5)通过实验④说明要加快化学反应速率可 或 。
查看答案和解析>>
科目: 来源: 题型:
市场上有一种加酶洗衣粉,它是在洗衣粉中加入少量的碱与蛋白酶制成的。蛋白酶的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质、油渍遇到它,都能水解而除去。下列衣料中,不能用加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④丝织品
A.① B.②③ C.①③ D.②④
查看答案和解析>>
科目: 来源: 题型:
浓度均为0.1 mol/L的下列五种溶液①Na2CO3溶液 ②NaOH溶液 ③NaHSO4溶液
④NH4Cl溶液 ⑤NaNO3溶液,PH的大小顺序为
A. ②﹥①﹥⑤﹥④﹥③ B。②﹥①﹥⑤=③﹥④
C. ①﹥②﹥⑤﹥④﹥③ D. ②﹥①﹥⑤﹥③﹥④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com