
科目: 来源: 题型:
下列叙述正确的是( )
A.共价化合物中一定没有离子键 B.阴、阳离子通过静电引力所形成的化学键叫离子键
C.离子化合物中一定没有共价键 D.非金属元素之间构成的化合物肯定不是离子化合物
查看答案和解析>>
科目: 来源: 题型:
有下列符号:35Cl和37Cl、O2和O3、1H216O和2H218O。下列有关说法正确的是 ( )
A.35Cl和37Cl互称为同素异形体 B.O2和O3是氧元素的两种同位素
C.35和37表示的是质量数 D.1H216O和2H218O表示同一种水分子
查看答案和解析>>
科目: 来源: 题型:阅读理解
阅读下表中短周期主族元素的相关信息。
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都要有E元素 |
请回答:
(1)在一定条件下,B2与C的单质在海水中可形成原电池,为新型海水航标灯提
供能源。 写出该原电池正极的电极反应式 。
(2)用惰性电极电解化合物AD的水溶液,该反应的化学方程式为:
其中,阴极产物是
(3)常温下,0.1 mol·L-1X溶液的pH_____7(填“>”、“=”或“<”),原因是 (用离子方程式说明)。向1.5 L O.1 mol·L-1 A的最高价氧化物对应水化物的水溶液中通人标况下2.24L EB2,充分反应后,溶液中各离子浓度由大到小的顺序是 。
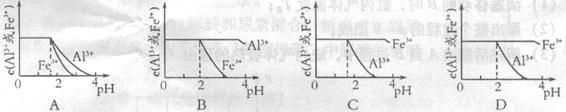
(4)已知![]() mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
mol4·L一4。现向pH=0,浓度均为0.04mol·L-1的Al3+、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是
(填字母代号)。
查看答案和解析>>
科目: 来源: 题型:
将0.1 mol/L的HA溶液与0.1 mol/L的NaOH溶液等体积混合后,测得混合溶液pH=8,则溶液中有关微粒的浓度关系错误的是
A.c(HA)+c(A-)=c(Na+)=0.1mol/L
B.c(Na+)-c(A-)=c(OH-)-c(H+)
C.c(A-)>c(Na+)>c(OH-)>c(H+)
D.c(OH-)=c(H+)+c(HA)
查看答案和解析>>
科目: 来源: 题型:
Zn和Al都具有两性,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1) Zn形成金属晶体,其金属原子堆积属于下列 模式
A.简单立方 B.钾型 C.镁型 D.铜型
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ; 葡萄糖[CH2OH(CHOH)4CHO]分子中手性碳原子有 个。
(3)锌与某种元素X通过共价键结合,形成空间网状结构的晶体,下图表示该化合物晶胞,该化合物的化学式为 ;该化合物的晶体熔点远远高于干冰,原因是 。
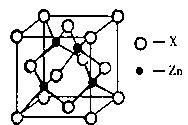
(4) AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,请问两分子AlCl3之间以 方式二聚。
(选择填写:“离子键”“共价键”“金属键”“氢键”)
(5 )超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,A1N晶体与金刚石类似,每个Al原子与 个N原子相连,与同一个Al原子相连的N原子构成的空间构型为 。在四大晶体类型中,AlN属于 晶体。
(6)与锌同周期,最外层有3个未成对电子数的元素名称是 ,该元素对应的最低价氢化物分子的中心原子采取了 杂化方式,分子的空间构型是 ,属于 分子(选择填写“极性”“非极性”)。
查看答案和解析>>
科目: 来源: 题型:
化合物A、B的相对分子质量均为86,C、H、O的原子个数之比为2∶3∶1。各物质之间的转化关系如下:
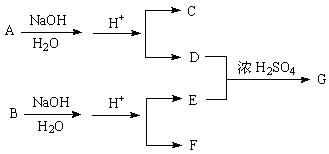
A、B、C均能使Br2的CCl4 溶液褪色,F可以发生银镜反应,E既不能发生银镜反应也不能使Br2的CCl4 溶液褪色。
提示:羟基直接连在碳碳双键上的结构(烯醇结构)不稳定,会发生如下重排:

请回答下列问题:
A的分子式是 。
A ![]() C + D 属于 反应(写反应类型)。
C + D 属于 反应(写反应类型)。
推出A、B、F结构简式 、 、 。
写出D + E ![]() G的化学反应方程式 。
G的化学反应方程式 。
写出满足下列条件的A的所有同分异构体(B不必再写):
是链状化合物
分子内含有![]() 的基团
的基团
写出A的聚合反应方程式 。
查看答案和解析>>
科目: 来源: 题型:
下面有关丙烷、丙烯、丙炔说法中正确的有( )

A.丙烷、丙烯、丙炔的结构简式分别为
B.相同物质的量的三种物质完全燃烧后,在标准状况下,生成的气体体积比7:6:5
C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高
D.丙烷、丙烯、丙炔三种物质分子中所有的碳原子都处在同一平面
查看答案和解析>>
科目: 来源: 题型:
为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案。
已知:2Na2O2+2CO2=== 2Na2CO3+O2 2Na2O2+2H2O=== 4NaOH+O2
甲:用图l所示装置,通过测定Na2O2与CO2反应生成O2的体积来测定样品的纯度。
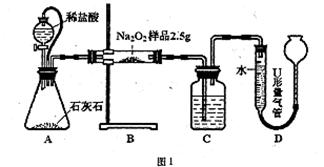
(1)C中所盛的药品是: 。
(2)A中橡皮管的作用是: 。
(3)利用该实验方案所测Na2O2的纯度明显偏大,其原因可能是 (填选项字母)。
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
乙:称取3.500 g试样,配成1000.00 mL溶液,用0.1000 mol·L-1的标准盐酸滴定。
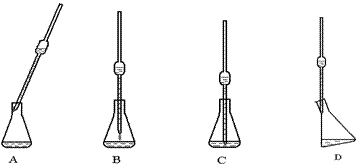
(4)取上述所配溶液25.00 mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图 ,取溶液所用仪器的名称是 。
(5)滴定操作平行实验的数据记录如下表:
| 滴定次数 | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
由表中数据计算样品中Na2O2纯度为 。
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式中,属于水解反应且反应方程式正确的是:
A. S2-+H2O![]() HS-+OH- B. CO2+H2O
HS-+OH- B. CO2+H2O![]() HCO3-+H+
HCO3-+H+
C. CH3COOH+H2O![]() CH3COO-+H3O+ D. CO32-+2H2O
CH3COO-+H3O+ D. CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目: 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①![]()
②![]()
③![]()
下列说法不正确的是 ( )
A.等物质的量的CH4参加反应,反应①②转移的电子数相同
B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);⊿H=-618KJ/mol
C.0.2 mol CH4还原NO2至N2,且生成H2O(g)放出的热量为173.4kJ
D.若用4.48 L(标准状况)CH4还原NO2至N2,整个过程中转移电子1.60mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com