
科目: 来源: 题型:
下列叙述中,错误的是
A. 原子半径 Cl>S>O B. 还原性 Na>Mg>Al
C. 稳定性 HF>HCl>HBr D. 酸性 HClO4>H2SO4>H3PO4
查看答案和解析>>
科目: 来源: 题型:
甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是
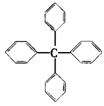
A.分子式为C25H20
B.所有的碳原子可能都在同一平面上
C.所有原子不可能在同一平面上
D.此物质属于芳香烃类物质
查看答案和解析>>
科目: 来源: 题型:
将甲、乙两种金属的性质相比较,已知①甲跟H2O反应比乙与H2O反应剧烈;②甲单质能从乙的盐溶液中置换出单质乙;③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲单质的熔、沸点比乙的低。能说明甲的金属性比乙强的是
A.①④ B.③⑤ C.①②③ D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
下列有关比较中,大小顺序排列错误的是
A.热稳定性:PH3>H2S>HBr>NH3
B.物质的熔点:石英>食盐>冰>汞
C.结合质子的能力:CO32- >CH3COO->SO42-
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCI3溶液
查看答案和解析>>
科目: 来源: 题型:
已知氧化剂XO(OH)2+ 被Na2SO3还原到低价。如还原含2.4×10-3molXO(OH)2+ 的溶液,需30mL0.2mol·L-1 的Na2SO3溶液,则X元素的最终价态为
A.+2 B.+1 C.+3 D.0
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A.原子序数:A>B>C>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
查看答案和解析>>
科目: 来源: 题型:
(本题共13分)以下两个化学实验是某小组的同学对海水中化学资源的探究活动。

(一)从海带灰中提取碘
从海带灰中提取碘的实验流程如下:
实验流程中,括号里①②③表示的是操作方法,请填写:
① ② ③
(2) 实验流程中,“煮沸2~3分钟”主要作用是 。
(3)实验流程中,“滴加稀硫酸和加入H2O2”主要作用是______________。
(二) 测定卤水中硫酸镁的含量
用海水制盐,分离出食盐后的卤水,主要含有氯化钠和硫酸镁。测定卤水中硫酸镁含量的实验步骤如下:
①量取该卤水样品100mL。
②取用一定物质的量浓度的氢氧化钠溶液100mL,平均分四次依次加入到该100mL卤水样品中,充分振荡。
③每次实验所得数据见下表
|
| 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的体积/mL | 25 | 25 | 25 | 25 |
| 生成沉淀的总质量/g | 0.29 | X | 0.87 | 0.87 |
查看答案和解析>>
科目: 来源: 题型:
常温下,将盛有10 mL NO2、10 mL NO混合气体的试管倒置在水中,并向其中通入氧气,一段时间后试管内尚余2 mL O2,则通入氧气的体积为( )
A.7.5 mL B.8.5 mL C.10 mL D.12 mL
查看答案和解析>>
科目: 来源: 题型:
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2 (g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g) = 2CO2 (g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式 。
(3)在25℃下,向浓度为0.1 mol·L-1的AlCl3溶液中逐滴加入氨水,生成该沉淀的离子方程式为______________________________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为中性,则
Va︰Vb= 。
(6)在25℃下,将a mol·L-1的氨水![]() 与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com