
科目: 来源: 题型:
下列有关Na2CO3 和NaHCO3的性质比较中,错误的是
A.热稳定性:Na2CO3 >NaHCO3 B.溶解度:Na2CO3<NaHCO3
C.与盐酸反应的速率:Na2CO3 <NaHCO3 D.相对分子量:Na2CO3 >NaHCO3
查看答案和解析>>
科目: 来源: 题型:
Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是:
①钠的化合物 ②能与硝酸反应的物质 ③可溶于水的物质 ④电解质 ⑤钠盐 ⑥钠的含氧化合物
A.①③④⑤ B.①②⑤⑥ C.②⑤⑥ D.①③④
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒
B.标准状况下,1.12 L的NH3所含的原子数是0.2NA
C.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
D.16.9 g 过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA
查看答案和解析>>
科目: 来源: 题型:
下列各说法正确的是
A.对于![]()
![]() (Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ
(Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ
B.热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示
C.需要加热才能发生的反应不一定是吸热反应
D.小苏打在水中的电离方程式:![]()
查看答案和解析>>
科目: 来源: 题型:
喷泉是一种常见的现象,其产生的原因是存在压强差。
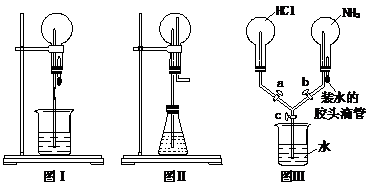
(1)图Ⅰ为化学教学中常用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是
A. SO2和H2O B. CO2和NaOH溶液 C. NH3和H2O D. NO和H2O
(2)在图Ⅱ的锥形瓶中,分别加入足量的下列物质后,能产生喷泉的是
A. Cu与稀硫酸 B. Cu与稀硝酸 C. Al与浓硫酸 D. Fe与浓硝酸
(3)比较图Ⅰ和图Ⅱ两套装置,从产生喷泉的原理来分析,图Ⅰ是 上部烧瓶内气体压强;图Ⅱ是 下部锥形瓶内气体压强(填“增大”或“减小” )。
(4)某学生积极思考喷泉原理的应用,设计了如图Ⅲ所示的装置。
① 如果关闭活塞c,打开活塞a、b,再挤压胶头滴管。则可能出现的现象为 。
② 在①操作的基础上,打开活塞c,产生的现象是 。
查看答案和解析>>
科目: 来源: 题型:
25℃时,(1)、将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)、pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)、物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)、将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
(5)、相同物质的量浓度的NH4HSO4和(NH4)2SO4溶液,都呈 性,前者显酸性的主要原因是 ;后者显酸性的主要原因是 。
查看答案和解析>>
科目: 来源: 题型:
我省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的。粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)为了除去粗盐中的泥沙,可采用的提纯方法的实验操作方法的名称是 。
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸。其中,在步骤③中涉及的离子反应方程式有
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是 。(NA表示阿伏伽德罗常数)
A.粗盐中Na+数目为 B.精盐中NaCl物质的量为 mol
C.粗盐中NaCl的质量分数为 x100℅ D.粗盐中关于NaCl的量无法确定
(4)含碘食盐往往加入KIO3,为了检验实验中是否含KIO3,可以用以下反应进行:
KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
①用单线桥分析以上反应中电子转移的方向和数目。
②将以上反应改写成离子方程式 。
③为了获取反应后溶液中的I2,可采用的实验操作方法的名称是 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值_______________(填“一定增大”“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O (g) ![]() CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
CO和H2O物质的量浓度变化如下图(a)所示,则:
① 0-4min间平均反应速率v(CO)=________ mol??L-1??min-1
②在800℃时该反应的化学平衡常数K=___________________________(要求写出表达式及数值);CO的转化率=______________。

图(a)
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol/L和0.80 mol/L,则达到平衡时CO转化为CO2的转化率是:______________________。
(3)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是_______
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比, c(Mg2+)后者大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃ 时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是 。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com