
科目: 来源: 题型:
将pH=1的稀硫酸慢慢加入一定量的Ba(NO3)2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原Ba(NO3)2溶液中NO3-的浓度为
A.0.011mol·L-1 B.0.022mol·L-1
C.0.11mol·L-1 D.0.22mol·L-1
查看答案和解析>>
科目: 来源: 题型:阅读理解
硫酸亚铁药片(外表包有一层特质的糖衣)是一种治疗铁性贫血的药剂。某化学课外活动小组为测定其中硫酸亚铁的含量,进行如下实验:
I.甲同学要测定其中铁元素含量,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)刮除药片的糖衣,甲同学如下称得样品ag,则你认为a=_____。

(2)将其碾碎后迅速溶解,配制250mL溶液。配制溶液时除烧杯、玻璃棒、量筒、250mL容量瓶外,还必须有的玻璃仪器__________。
(3)洗涤沉淀的操作是_____________________________________________。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,据此结果,还应进行的操作是________________________________________。
根据测得的数据可计算出硫酸亚铁的含量。
II、乙同学根据反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,采用滴定的方法测定其中硫酸亚铁的质量分数。
(5)取上述甲同学所配置的待测液25.00mL置于锥形瓶中,并将0.02mol/L KMnO4的标准溶液装入_____(“酸式”或“碱式”)滴定管中,调节液面至“0”刻度。
(6)滴定操作时,眼睛注视_________________________。
(7)滴定待测液至终点,如此滴定三次,实验数据如下表所示:
(其中第一次滴定给点的数据如右图,请你你读得的数据填入表中)

样品中硫酸亚铁的质量分数为_____。(保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
化学与社会、生活密切相关,下列有关说法不正确的是 ( )
A.利用清洁能源代替化石燃料,有利于节约资源、保护环境
B.食品添加剂种类很多,其中的一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐
C.抗酸药的种类很多,如碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等
D.乙醇属于可再生能源
查看答案和解析>>
科目: 来源: 题型:
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数) ( )
A.若R(OH)m为强碱,则W(OH)n也为强碱
B.若HXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
查看答案和解析>>
科目: 来源: 题型:
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
 |
请回答下列问题:
(1)操作①应包括下列操作中的 (填序号)。
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是 。
(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+ (填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。;用简要的文字解释需用氢氧化钠调节pH至9~11的原因 。
(6)已知大理石含CaCO3的质量分数为a,mg大理石可以制得ngCaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率为
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式书写不正确的是( )
A.氢氧化钡溶液中滴加硫酸氢钾溶液至pH=7:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.在氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O
C.用SO2还原含Cr2O72-的酸性废水:Cr2O72- + 3SO2 + 2H+ = 2Cr3+ + 3SO42-+ H2O
D.用小苏打治疗胃酸过多: CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4
下列说法不正确的是 ( )
A.①中MnO2和H2SO4都是氧化剂 B.①中析出16gS时转移1 mol电子
C.②中MnSO4发生氧化反应 D.硫酸在该生产中可循环利用
查看答案和解析>>
科目: 来源: 题型:
[化学—选修化学与技术]请回答有关氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=____(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是________(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
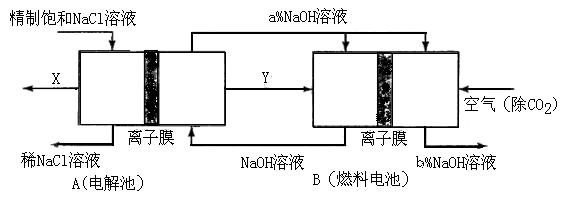
①图中X、Y分别是____、____(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:____;负极:____;③这样设计的主要节(电)能之处在于(写出2处)________、________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com