
科目: 来源: 题型:
接触法制硫酸通常在400~500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3 。2SO2(g)+O2(g)![]() 2SO3(g) △H<0,在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件获得SO3 ,采取加压措施的目的
2SO3(g) △H<0,在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件获得SO3 ,采取加压措施的目的
A.发达国家电能过量,以此消耗大量能源
B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率
C.加压可使SO2全部转化为SO3 ,消除SO2对空气的污染
D.高压有利于加快反应速率,提高生产效率
查看答案和解析>>
科目: 来源: 题型:
火箭推进器常以联氨(N2H4)为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-533.23 kJ·mol-1
H2O(g)=H2O (l) DH2=–44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH3=–196.4 kJ·mol-1
则联氨与过氧化氢反应的热化学方程式可表示为
A.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l) ΔH=+817.63 kJ·mol-1
B.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) ΔH=-641.63 kJ·mol-1
C.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l) ΔH=-641.63 kJ·mol-1
D.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) ΔH=-817.63 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
则△H1、△H2、△H3、△H4的数学关系式是 。
查看答案和解析>>
科目: 来源: 题型:
下列变化属于放热反应的是
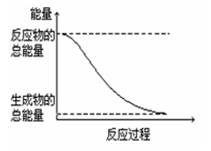
A.H2O(g)=H2O(l) △H=-44.0 kJ/mol
B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol
C.形成化学键时放出能量的化学反应
D.能量变化如右图所示的化学反应
查看答案和解析>>
科目: 来源: 题型:
下列叙述中正确的是( )
A.1 mol CO的质量是28 g
B.硝酸的摩尔质量63 g
C.2 g氢气所含原子数目为1 mol
D.铁的摩尔质量在数值上等于铁原子的相对原子质量
查看答案和解析>>
科目: 来源: 题型:
用0.01mol/LH2SO4滴定0.01mol/LNaOH溶液,中和后加水至100ml,若滴定时终点判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05ml),则①和
②c(H+)之比是( )
A.10 B.50 C.5×103 D.104
查看答案和解析>>
科目: 来源: 题型:
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10l kPa,温度为0℃)。
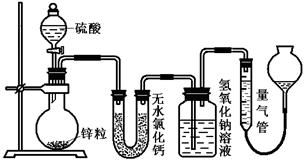
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重l.28 g ,则圆底烧瓶中发生反应的化学方程式为:_______________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g量气管中收集到VmL气体,则有方程:a g/65g·mol-1=b g/64g·mol-1+V mL / 22400 mL·mol-1,其依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,再加入V L c mol/L 浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重m g,则整个实验过程产生的混和气体中H2和SO2物质的量之比 n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的比值将 (填
偏大、偏小或无影响)
查看答案和解析>>
科目: 来源: 题型:
纳米科技从本世纪初开始成为产业,为世人所瞩目,这是因为纳米粒子的直径在几纳米到100纳米之间,由纳米材料作为分散质的分散系具有的性质是( )
A.能透过滤纸,属最稳定的分散系 B.不能透过半透膜,属介稳体系
C.有丁达尔现象,没有布朗运动 D.一定能导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com