
科目: 来源: 题型:
新制的氯水显 色,说明氯水中有 存在,蓝色石蕊试纸遇到氯水后,首先变红,起作用的成分是 ,但很快又褪色,起作用的成分是 ,氯水经光照后产生气体,该反应的化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
如下图所示物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.
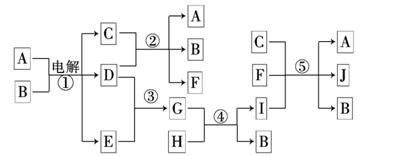
请回答下列问题:
⑴写出F的化学式:________________;
⑵人们将反应①涉及的化学工业称为 ________________;
⑶写出电解A、B混合液的阳极反应式 ;
⑷ 写出B与D反应的离子方程式________________________________________;
⑸写出反应④的离子方程式______________________________________________;
⑹写出反应⑤的离子方程式______________________________________________;
⑺高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强氧化性可杀菌消毒;
②___________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
B.NaNO2溶液中加入酸性KMnO4溶液:
2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
C.漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO-
D.向NH4Al(SO4)2溶液中不断滴加Ba(OH)2至溶液中SO42-完全沉淀;
2Ba2-+4OH-+Al3++2SO42=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目: 来源: 题型:
钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3??x H2O),写出铁发生电化学腐蚀时负极的电极反应:___________________________________ 。
(2)下列各个装置中铁棒被腐蚀由难到易的顺序是_______________(填字母)。
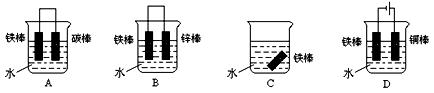
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如图,请回答:
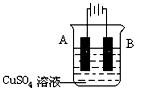
① A电极的电极反应式是 __
② 若电镀前铁、铜两电极的质量相同,电镀完成后, 若电镀时
电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差____g。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
查看答案和解析>>
科目: 来源: 题型:
下列用来表示物质变化的化学用语中,正确的是
A.甘氨酸与氢氧化钠溶液反应:![]()
B.向苯酚钠溶液中通入少量的CO2:CO2 + H2O + 2C6H5O-![]() 2C6H5OH + 2CO32-
2C6H5OH + 2CO32-
C.电解CuSO4溶液:Cu + 2H2O == Cu2+ + H2 + Cu(OH)2
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e—=Fe2+
查看答案和解析>>
科目: 来源: 题型:
下列化学用语正确的是
A.S原子的结构示意图: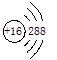
B.明矾的化学式:KAlSO4·12H2O
C.乙醇的结构式: 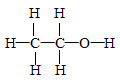
D.碳酸钠的电离方程式: Na2CO3 = Na2 + + CO32ˉ
查看答案和解析>>
科目: 来源: 题型:
将表面被氧化的铜片和铁片,同时加入足量稀盐酸中,除尽氧化膜。再经充分反应后,溶液中一定含有的金属离子是
A.Fe3+和Cu2+ B.Fe2+ C.Fe2+和Cu2+ D.Fe2+和Fe3+
查看答案和解析>>
科目: 来源: 题型:
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2![]() 2CO2+3H2O,制取二甲醚的反应如下:
2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO(g)+2H2(g)![]() CH3OH(g) △H=-90.7kJ·mol-1
CH3OH(g) △H=-90.7kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式: 。
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为 极,电极反应式为
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________________________________________
②生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
③下列哪个装置可防止铁棒被腐蚀_____________
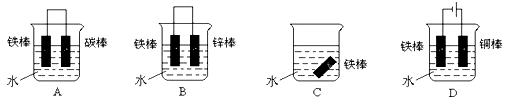
④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:

A电极对应的金属是 (写元素名称),
B电极的电极反应式是 ________________
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,两个恒容密闭容器中分别发生下列两个反应:①H2(g)+I2(g)![]() 2HI(g) ②C(s)+H2O(g)
2HI(g) ②C(s)+H2O(g)![]() CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
a.各物质的浓度不变 b.容器内气体压强不变
c. 容器内气体密度不变 d.容器内气体颜色不变
e.各组分的物质的量分数或质量分数不变
A.abc B.ade C.ac D.ae
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体。E是地壳中含量居第二位的金属。D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素。有关的转化关系如下图所示(反应条件均已略去):
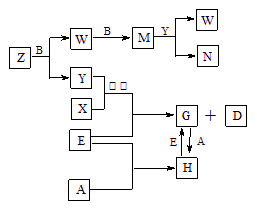
(1)A的化学式为 ,B的化学式为 ,C的电子式为 。
(2)Z和W在催化剂和加热的条件下反应生成C和Y,这是一个很有意义的反应,可以消除W对环境的污染,该反应的化学方程式为 。
(3)将N溶液滴入G的溶液中会产生W,写出上述变化的离子反应方程式:
。
(4)Z与N恰好反应后产物溶解在水中,所得溶液的pH(填“大于”、“小于”或“等于”) 7,用离子反应方程式表示其原因为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com