
科目: 来源: 题型:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示:
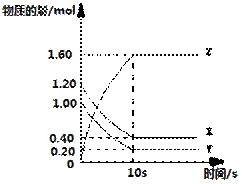
(1)该反应的化学方程式为: 。
(2)反应开始至10s末,X的平均反应速率为: 。
(3)若在第10s时分离出部分Y,则容器中X的物质的量会________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:阅读理解
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
| A-B | A=B | A≡B | ||
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___ 、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下:
查看答案和解析>>
科目: 来源: 题型:
据美国《科学》杂志报道,外太空的某个星球的大气层中含有大量的CH2=CHOH,此物质常温下为液体,不稳定,易转化为CH3CHO,化学方程式为CH2=CHOH![]() CH3CHO △H<0。据此,以下叙述中,不正确的是 ( )
CH3CHO △H<0。据此,以下叙述中,不正确的是 ( )
A.该星球表面温度很低
B.低温下稳定性:CH2=CHOH < CH3CHO
C.该星球表面温度很高
D.高温下稳定性:CH2=CHOH > CH3CHO
查看答案和解析>>
科目: 来源: 题型:
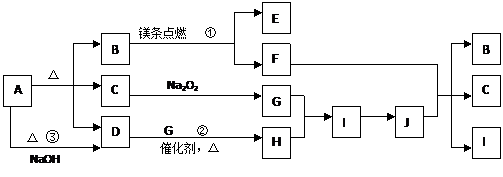 |
请填写以下空白:
⑴B的电子式______________,D分子的空间构型_________________。
⑵写出反应①、②的化学反应方程式:
①_____________________________________________________________;
②_____________________________________________________________。
⑶写出反应③的离子方程式:____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
砹是原子序数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是
①砹化氢很稳定 ②砹单质与水反应,砹全部转化成氢砹酸和次砹酸 ③砹是黑色固体 ④砹化银难溶于水 ⑤ 砹易溶于某些有机溶剂
A.只有①② B.只有①③④ C.只有③④⑤ D.只有②④⑤
查看答案和解析>>
科目: 来源: 题型:
[化学——选修物质结构与性质]
A、B、C、D是原子序数依次递增的短周期元素,四种元素的质子数之和小于23。
A元素原子的电子总数等于其基态原子的电子层数。B元素原子的价电子结构为![]() 。C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但
。C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但
其单质的熔点却低于同周期左右相邻元素的单质。D的电负性大于C。
(1)B、C、D分别是 、 、 ;
(2)C、D分别与A形成的最简单分子中,稳定性较高的是 (填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会发生改变,其原因是 。
(3)BD2分子的晶体结构为密堆积,则每个BD2分子周围紧邻的分子有 个;
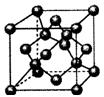
(4)上图为B元素的某种单质晶体X的晶胞,其中含有 个B原子,该晶体
(填“形成”或“没有形成”)最密堆积结构,原因是 。试分析比较晶体X与晶体BD2的熔点 。
查看答案和解析>>
科目: 来源: 题型:
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+ 。下列叙述不正确的是
A.氧化产物为Cl2
B.氧化剂与还原剂的物质的量之比为1∶2
C.若有3mol H2O生成,则反应中有2mol电子转移
D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移
查看答案和解析>>
科目: 来源: 题型:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
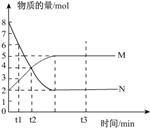
(1)此反应的化学方程式中a :b=__________;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________________;
(3)下列叙述中能说明上述反应达到平衡状态的是_______________。
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com