
科目: 来源: 题型:
锂被誉为“高能金属”。工业上用浓硫酸与β-锂辉矿(Li2Al2Si4O12和少量钙镁杂质)在250~300℃反应,生成Li2SO4、硅铝化合物以及MgSO4等,其工业生产流程如下:
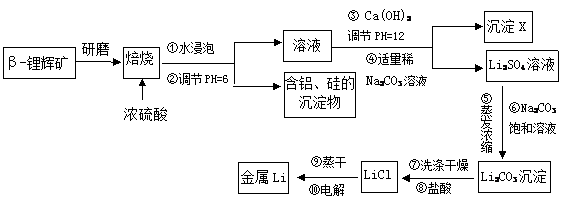
已知: Al3+、Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为5.2和12.4
(1)用氧化物形式表示Li2Al2Si4O12的组成:_____________ ______。
(2)沉淀X的主要成分是(写化学式):______________、___ _____。
(3)写出第③步操作发生反应的化学反应方程式: 。
(4)简述流程中两次使用不同浓度的碳酸钠溶液的目的?
。
查看答案和解析>>
科目: 来源: 题型:
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量Q kJ,则乙炔燃烧的热化学方程式正确的是
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-2Q kJ·mol-1
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l); ΔH=2QkJ·mol-1
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-4Q kJ·mol-1
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=Q kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
下列有关实验操作错误的是( )
A.用胶头滴管取少量液体试剂
B.用纸槽向试管底部加入粉未状药品
C.用燃着的酒精灯点燃另一盞酒精灯
D.用排水法收集难溶于水的气体
查看答案和解析>>
科目: 来源: 题型:
对可逆反应2A(s)+3B(g)![]() C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 ( )
C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 ( )
①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,v(正)减小 ③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高?
A.①② B.④ C.③ D.④⑤
查看答案和解析>>
科目: 来源: 题型:
下列所述事实与化学(或离子)方程式不相符的是
A.能说明盐酸是强酸:2HCl+CaCO3=CaCl2+H2O+CO2↑
B.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O
C.能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O
D.能说明CH3COOH是弱电解质:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目: 来源: 题型:
在10 ℃时,某化学反应速率为0.1 mol·L-1·s-1,若温度每升高10 ℃,反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol·L-1·s-1,则该反应需在什么温度下进行( )
A.30 ℃ B.40 ℃? C.50 ℃ D.60 ℃
查看答案和解析>>
科目: 来源: 题型:
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放出(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示;现提供以下化学键的键能(kJ·mol-1)P—P:198;P—O:360;O=O:498,则反应P4(白磷)+3O2 = P4O6的反应热ΔH为( )
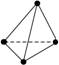
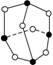
白磷 P4O6
A.-1638 kJ·mol-1 B.-126 kJ·mol-1
C.+1638 kJ·mol-1 D.+126 kJ·mol-
查看答案和解析>>
科目: 来源: 题型:
用双线桥标出以下方程式中元素化合价变化、电子转移及数目并指出氧化剂还原剂。
(1)4Al + 3O2 == 2Al2O3 (2)2H2O2 === 2H2O + O2↑
查看答案和解析>>
科目: 来源: 题型:
下列离子反应方程式,书写正确的是………………………………………….( )
A. 向碳酸钠溶液中加盐酸 CO32- + 2H+ = H2O +CO2 ↑
B.向稀硫酸溶液中投入铁粉 2Fe +6H+ = 2Fe3+ +3H2 ↑
C. 向盐酸中投入碳酸钙 CO32- + 2H+ = H2O +CO2 ↑
D. 氢氧化钡溶液中加入硫酸 H+ + OH- =H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com