
科目: 来源: 题型:
小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有
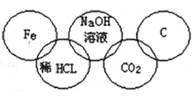
A.复分解反应、1个 B.分解反应、2个
C.化合反应、3个 D.置换反应、2个
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为2 mol/L
C.配制480 mL 0.5 mol/L的CuSO4溶液,需称取62.5 g胆矾
D.中和100 mL 1mol/L的H2SO4溶液,需NaOH为4 g
查看答案和解析>>
科目: 来源: 题型:阅读理解
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3 ![]()
![]() + H+ Ka1(H2CO3)=4.45×10—7
+ H+ Ka1(H2CO3)=4.45×10—7
![]()
![]()
![]() +H+ Ka2(HCO3-)=5.61×10-11
+H+ Ka2(HCO3-)=5.61×10-11
HclO ![]() H++
H++![]() Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。

实验一、定性研究:
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,
有少量气泡产生,溶液浅黄绿色褪去;
② 过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③ 为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
① 反应后所得的溶液漂白性增强的原因是______ ___________ ____
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有______ _ 。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状 碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
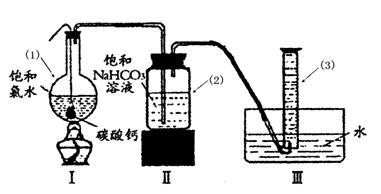
请回答:
③ 写出仪器(1)与仪器(3)的名称
(1) (3)
④ 为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
⑤ 如何准确读出量筒中气体的体积
a________ _
b 上下移动量筒至量筒内液面与水槽液面相平
c
查看答案和解析>>
科目: 来源: 题型:
在强酸性溶液中,能大量共存的离子组是 ( )
A.NH4+ 、Na+ 、Cl-、SO42- B.Cu2+、Ca2+ 、CO32- 、Cl-
C.Al3+、 Ag+ 、NO3-、Cl- D.K+、HCO3-、Cl-、 Na+
查看答案和解析>>
科目: 来源: 题型:
有10.2克镁铝合金恰好溶于250mL 4mol·L-1的盐酸中,现加入2mol·L-1的氢氧化钠溶液。请回答:
(1)要使产生的沉淀的质量最大,需加入的氢氧化钠溶液的体积是 mL
(2)要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积是 mL
查看答案和解析>>
科目: 来源: 题型:
检验铵盐溶液的方法是:将待测物质取出少量,放在试管中,然后( )
A.加热,用蘸有浓盐酸的玻璃棒置于试管口检验
B.加热,用湿润的红色石蕊试纸置于试管口检验
C.加强碱溶液后加热,再滴入无色酚酞试液
D.加烧碱溶液后加热,再用湿润的红色石蕊试纸置于试管口检验
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是( )
A.明矾溶液与氢氧化钡溶液反应,使SO恰好完全沉淀:Al3++2SO+2Ba2++3OH-===2BaSO4↓+Al(OH)3↓
B.向FeBr2溶液中通入过量氯气:2Fe2++Cl2===2Fe3++2Cl-
C.用铂电极电解MgCl2溶液时发生的反应:2Cl-+2H2OCl2↑+H2↑+2OH-
D.常温下将硝酸铵溶液与KOH溶液混合:NH+OH-===NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,Hg(N3)2可作雷管的起爆剂,工业上制备NaN3的化学反应为:
I.N2H4(联氨) + HNO2 → HN3(叠氮酸) + H2O (未配平);
II.HN3 + NaOH →NaN3 + H2O
⑴上述反应I中,每生成4.3g HN3时,消耗联氨的物质的量为 ,NaN3受撞击时迅速分解为两种单质,该反应的化学方程式为 。
⑵ 联氨的电子式为 。
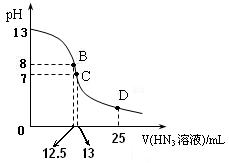
⑶ 上图为常温下向25mL、0.1mol/L NaOH溶液中逐滴滴加0.2mol/L的HN3溶液的过程中溶液pH的变化曲线。(溶液混合时体积的变化忽略不计)
① D点时溶液中各离子的浓度由大到小的顺序为
② B点时溶液中c (HN3) =
查看答案和解析>>
科目: 来源: 题型:
下列判断错误的是( )
A.沸点: NH3>PH3 >AsH3 B.熔点: Si3N4 > NaCl > Si I4
C.酸性:HClO4>H2SO4>H3PO4 D.碱性:NaOH > Mg(OH)2 > Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com