
科目: 来源: 题型:
【化学——选修:物质结构与性质】 ( 15分)
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3 +5 | -2 +6 | -1 +7 | +2 | +1 +2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
请回答下列问题:
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)B的氢化物中心原子采取 杂化,空间构型是 形,是 分子
(填“极性”或“非极性”);
(3)F2+与NH3 形成配离子的化学式为 ,F单质晶体晶胞是下图的
(填①、②、③或④);
(4)A 、E两种元素形成晶体晶胞是下图中的 (填①、②、③或④),A离子的配位数是 ;

(5)右图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,
请选出C的氢化物所在的折线 (填n、m、x或y)。

查看答案和解析>>
科目: 来源: 题型:
下列溶液中微粒的物质的量浓度关系正确的是
A.室温下,向0.01mol·L![]() NH4Cl溶液中滴加NaOH溶液至中性:
NH4Cl溶液中滴加NaOH溶液至中性:
c(Na+) + c(NH4+) + c(H+) = c(OH![]() ) + c(Cl
) + c(Cl![]() )
)
B.0.1 mol·L![]() NaHCO3溶液:c(Na+) > c(OH
NaHCO3溶液:c(Na+) > c(OH![]() ) > c(HCO3
) > c(HCO3![]() ) > c(H+)
) > c(H+)
C.Na2CO3溶液:c(OH![]() ) = c(HCO3
) = c(HCO3![]() ) + 2c(H2CO3)
) + 2c(H2CO3)
D.25℃时,pH = 4.75、浓度均为0.1mol·L![]() 的CH3COOH、CH3COONa混合溶液:
的CH3COOH、CH3COONa混合溶液:
c(CH3COOH) > c(CH3COO![]() ) > c(H+) > c(OH
) > c(H+) > c(OH![]() )
)
查看答案和解析>>
科目: 来源: 题型:
实验室欲配制80mL 1.4mol/L的NaNO3溶液,试回答:
(1)用不到的仪器是: ;
A.烧杯 B.500mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒 F.100mL容量瓶
(2)配制时应称取NaNO3 g;
(3)下列操作的顺序是(用字母表示) ;
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
(4)在配制一定物质的量浓度溶液的实验中,下列操作对所配得溶液无影响的是(写序号) ;会使所配溶液的浓度偏大的是 。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
B.未将洗涤烧杯内壁的溶液转移入容量瓶;
C.容量瓶中所配的溶液液面未到刻度线便停止加水;
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出;
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;
F.将容量瓶中液面将达到刻度线时,俯视刻度线和液面。
查看答案和解析>>
科目: 来源: 题型:
检验某未知溶液中是否含有SO42-的下列操作中最合理的是
A.加入盐酸酸化了的硝酸钡溶液 B.先加硝酸酸化,再加硝酸钡溶液
C.加入盐酸酸化的氯化钡溶液 D.先加盐酸酸化,再加氯化钡溶液
查看答案和解析>>
科目: 来源: 题型:
100 mL 0. 1 mol / L的盐酸与50 mL 0.2 mol / L的氨水混合,充分反应后,所得溶液中各种离子浓度关系正确的是( )
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)=c(NH4+ )>c(OH-)=c(H+)
C.c(H+)+c(NH4+ )=c(Cl-) +c(OH-)
D.c(H+)+c(Cl-)=c(NH4+)+c(NH3·H2O)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
主族元素W、X、Y、Z位于同一周期,原子序数依次增大,W、X是金属元素,Y、Z是非金属元素。W、X的最高价氧化物对应的水化物可以相互反应, W与Y 可形成化合物W2Y,Y的最外层电子数是核外电子层数的2倍。下列说法正确的是( )
A.Y的气态氢化物比Z的气态氢化物稳定
B.W的最高价氧化物对应的水化物是最强的碱
C.Y单质和氧气、氢气都能发生化合反应,且产物都具有还原性
D.W、X、Y、Z四种元素的原子半径由小到大的顺序是:W<X<Y<Z
查看答案和解析>>
科目: 来源: 题型:
氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为 ▲ 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 ▲ 。该工艺选择氯气的优点是 ▲ 。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为10-3 mol/L,则理论上生成的SO42-为 ▲ mol/L。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4+ + 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。可取甲醛b mL于锥形瓶,加入1滴酚酞,用浓度为C mol/L的NaOH溶液中和,滴定管的初始读数V1 mL,当溶液呈微红色时,滴定管的读数V2 mL。
②向其中加入饱和食盐水试样a mL,静置1分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3 mL。
则饱和食盐水中的含氮量为 ▲ mg/L。
查看答案和解析>>
科目: 来源: 题型:
工业接触法制硫酸的吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到58.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果如下表;
| 不同质量铵盐/g | 25.00 | 50.00 | 75.00 | 100.00 |
| 浓硫酸增加的质量/g | 相同 | 相同 | 1.70 | 0 |
查看答案和解析>>
科目: 来源: 题型:
某药物分子结构简式如下图所示,下列关于该物质的说法不正确的是
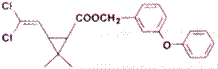
A.分子式为C21H20O3Cl2
B.醚键上的氧原子至少与另外11个原子共面
C.分子中不存在手性碳原子
D.在一定条件下可发生加成、取代、氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com