
科目: 来源: 题型:
为使人们确知含碘物质的存在,研究性学习小组同学设计了一种简便的检验方法,利用该物质在酸性条件下与KI反应有单质碘生成的性质,选用下列生活常见的物质就可完成。请你从下列物质中选出合适的一组( )
①自来水 ②食醋 ③淀粉 ④食糖 ⑤碘化钾试纸 ⑥碘酒
A.①③④⑤ B.②③④⑤? C.①③⑤⑥ D.①②③⑤
查看答案和解析>>
科目: 来源: 题型:
在一支25 mL的酸式滴定管中盛入0.lmol·L-1 HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.lmol·L-1 NaOH 溶液进行中和.则所需 NaOH 溶液的体积 ( )
A.大于20 mL B.小于20 mL
C.等于20 mL D.等于5 mL
查看答案和解析>>
科目: 来源: 题型:
8对于反应:TiCl4+4Na==4NaCl+Ti,下列说法正确的是 ( )
A.该反应说明钠是强还原剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C.Ti是氧化产物
D.TiCl4是还原剂
查看答案和解析>>
科目: 来源: 题型:
在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为 ( )
A.![]()
![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
![]() -NMR(核磁共振)可以用于含碳化合物的结构分析。
-NMR(核磁共振)可以用于含碳化合物的结构分析。![]() 表示的碳原子 ( )
表示的碳原子 ( )
A.核外有13个电子,其中4个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
查看答案和解析>>
科目: 来源: 题型:
对一份白色固体,经过初步分析得知,其含有Na2CO3、Na2SO4、NaCl、CuSO4等物质中的一种或几种。甲乙两位同学为了进一步确定这份白色固体的组成成份而进行了如下实验,但实验中的有些问题还需你来作答。
(1)甲取少量白色固体在试管内用水溶解,结果得无色澄清的液体。因此,甲说肯定有一种物质不存在。这种物质的化学式是:______________
(2)甲又先后向那试管内加入了稍过量的BaCl2溶液和稀硝酸,结果是先产生了白色沉淀,后又有一部分沉淀消失并从溶液里冒出无色气泡。因此甲又说肯定有两种物质存在。这两种物质是:______________、_____________。
(3)乙将甲所得混合物进行了过滤,取滤液约2ml盛于另一支洁净的试管里,然后又向该试管内加入了稍过量的AgNO3溶液和稀硝酸,结果也产生了白色沉淀。因此乙说那份白色固体中也肯定有NaCl。你说乙的结论(填“对”或“不对”)__________,理由是:________________
查看答案和解析>>
科目: 来源: 题型:
a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与c的最外层电子数之比为2∶3,b的最外层电子数比c的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红.
(1)e的元素符号是 .
(2)a、b、c的氢化物稳定性顺序为(用分子式表示) ;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为 ,Z的晶体类型为 ;ab-离子的电子式为 .
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示) .
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为 .
查看答案和解析>>
科目: 来源: 题型:
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A.加少量烧碱溶液 B.升高温度 C.加少量冰醋酸 D.加水
查看答案和解析>>
科目: 来源: 题型:
某有机化合物X(C3H2O)与另一有机化合物Y发生如下反应生成化合物Z(C11H14O2):
X+Y![]() Z+H2O
Z+H2O
(1)X是下列化合物之一,已知X不能与FeCl3溶液发生显色反应。则X是 (填标号字母)。
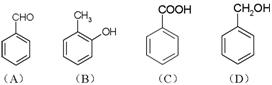
(2)Y的分子式是 ,可能的结构简式是: 和 。
(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经酸化可得F(C4H8O3)。F可发生如下反应:
F![]()
![]() +H2O
+H2O
该反应的类型是 ,E的结构简式是 。
(4)若Y与E具有相同的碳链,则Z的结构简式为: 。
查看答案和解析>>
科目: 来源: 题型:
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是___________;
(2)指出实验步骤中存在的错误并改正:___________;
(3)硫酸钠不能放置在空气中冷却的原因是___________;
(4)步骤⑤的目的是___________;
(5)下面的情况有可能造成测试结果偏高的是________________________(填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时晶体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com