
科目: 来源: 题型:
一定条件下,氨气与氟气发生反应:4NH3+3F2 ![]() NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是( )
NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是( )
A.NF3是极性分子
B.NF3既是氧化产物,又是还原产物?
C.NH4F中既含有离子键又含有共价键
D.上述反应中,反应物和生成物均属于分子晶体
查看答案和解析>>
科目: 来源: 题型:阅读理解
发展混合动力车是实施节能减排的重要措施之一。混合动力车可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ。则该反应的热化学方程式为 。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理如下图,其总反应式是:
H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。

根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将
(填“增大”、“不变”或“减小”),该电极的电极反应式为 ;在刹车和下坡时甲电极的电极反应为 。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
(g)。已知:平衡时各物质的浓度关系有![]()
已知:平衡时各物质的浓度关系有![]() ,K是一个只与温度有关的常数,称为化学平衡常数。
,K是一个只与温度有关的常数,称为化学平衡常数。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编 号 | c(CO)/ mol/L | c(O2)/ mol/L | c(CO2)/ mol/L | v(正)和v(逆)的比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)= v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 |
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5 mol/L和1.0×10-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol/L,则最终尾气中CO的浓度为 。
查看答案和解析>>
科目: 来源: 题型:
“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是 ( )
A.2Na + 2H2O=2NaOH + H2↑是酸碱反应
B.ClO-+ H2O![]() HClO + OH-是酸碱反应
HClO + OH-是酸碱反应
C.碱性强弱顺序:ClO—>OH—>CHCOO—
D.HCO3-既是酸又是碱,NH3既不是酸又不是碱
查看答案和解析>>
科目: 来源: 题型:
含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是 ( )
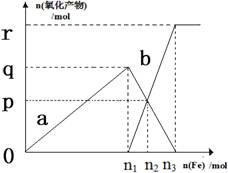
A.a是Fe(NO3)2 B.n1 = 0.375
C.p = 0.20 D.n2 = 0.30
查看答案和解析>>
科目: 来源: 题型:
H2O2可以作为脱氯剂,反应方程式为:H2O2+Cl2==2HCl+O2,下列说法错误的是( )
A.该反应为置换反应 B.生成1mol O2需转移电子4mol
C.H2O2被氧化 D.H2O2分子中含极性共价键
查看答案和解析>>
科目: 来源: 题型:
有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:
⑴、写出由A、C、D三种元素形成的化合物的的电子式为 ▲ ,该化合物的化学键类型为 ▲ ,晶体类型为 ▲ 。
⑵、B的氢化物的沸点比同主族其他氢化物的沸点高,这可用 ▲ 来解释。
A.极性分子 B.氢键 C.共价键 D.离子键
⑶、D2E溶液呈 ▲ (填“碱性”、“酸性”、“中性”),试用离子方程式解释原因 ▲ 。
⑷、0.5L 0.1 mol/L D的最高价氧化物的水化物与0.25L0.1 mol/LE的最高价氧化物的水化物反应放出2865 J的热量,该反应的热化学方程式为 ▲ 。
⑸、由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质。则其负极的电极反应离子方程式为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图: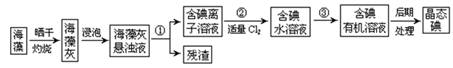
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;
(2)提取碘的过程中,可选择的有机试剂是 。
A.酒精 B.四氯化碳 C.苯
(3)实验操作③中,实验室已有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是 。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
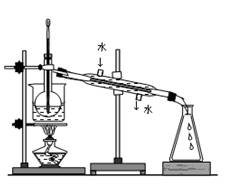
① ;
② ;
③ 。
(5)进行上述蒸馏操作时,使用水浴加热的原因是:
,
最后晶态碘在 里聚集(填仪器名称)。
查看答案和解析>>
科目: 来源: 题型:
小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型是
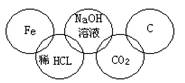
A、复分解反应 B、分解反应
C、化合反应 D、置换反应
查看答案和解析>>
科目: 来源: 题型:
把a L含(NH4)2SO4和NH4NO3 的混合液分为两等份:一份加入bmol 烧碱并加热,恰好把NH3全部赶出,另一份需含c molBaCl2溶液,使沉淀反应刚好完全,则NO3ˉ的浓度是
A. ![]() mol/L B.
mol/L B. ![]() mol/L
mol/L
C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
在一定温度和压强下,有如下反应:2SO2(g)+O2(g)![]() 2SO3(g),将1.6 mol SO2和0.8 mol O2放人一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题:
2SO3(g),将1.6 mol SO2和0.8 mol O2放人一体积可变的密闭容器中,测得容器的起始容积为100L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6g·L-1。请回答下列问题:
(1)达平衡时混合气体的体积为______________L,SO2的转化率为______________。
(2)若起始时加入a mol SO2、b mol O2,且a:b=2:1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120L。则a、b的值分别为:a=______________,b=______________。
(3)若容器为体积不变的密闭容器,其容积为100L。起始时加入χmol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则χ、y应该满足的关系式为______________,χ、z应该满足的关系式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com