
科目: 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的分子数为1 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,1 NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
查看答案和解析>>
科目: 来源: 题型:
.将a g无水Na2CO3溶于t℃的饱和Na2CO3溶液中,析出b g晶体,则(b-a) g表示的含义是 ( )
A.减少的饱和溶液的质量 B.饱和溶液失去溶质Na2CO3的质量
C.析出Na2CO3·10H2O的质量 D.饱和溶液失去水的质量
查看答案和解析>>
科目: 来源: 题型:
![]() 是一种大气污染物,某兴趣小组欲探究
是一种大气污染物,某兴趣小组欲探究![]() 的性质及绿色实验的方法,设计如下方案。
的性质及绿色实验的方法,设计如下方案。
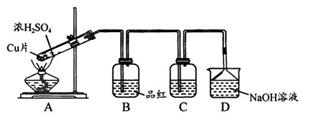
(1)装置A中发生反应的化学方程式为 ;
为了实现绿色实验的目标,甲同学重新设计了如下图A′制取装置:

与A装置相比,A′ 装置的优点是:
① ;
② ;
(2)换用A′ 装置后,继续进行下列实验。
I.验证![]() 的氧化性:C装置中可选试剂 (填序号);
的氧化性:C装置中可选试剂 (填序号);
A.Ba(HCO3)2溶液 B.氢硫酸 C.溴水 D.品红溶液
II.验证![]() 的还原性:C装置中可用试剂 (填名称);
的还原性:C装置中可用试剂 (填名称);
用该试剂的理由是① ;② ;
(3)D装置中导管下端倒置漏斗的作用是 ;
(4)工业生产硫酸有三个阶段,①其中用黄铁矿制备![]() 的化学反应方程式为:___________________________________________________,
的化学反应方程式为:___________________________________________________,
②尾气用氨吸收的目的是: 。w^w
查看答案和解析>>
科目: 来源: 题型:
两种气态烃以任意比例混合,在1200C时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体仍为10L。下列各组混合烃中不符合此条件的是
A.CH4、C2H4 B.CH4、C3H6 C.C2H4、C3H4 D.C2H2、C3H6
查看答案和解析>>
科目: 来源: 题型:
下列叙述中错误的是 ( )
A.相同体积的任何气体都含有相同数目的分子。
B.标准状况下,5L H2S气体与5L NH3的原子个数比为3∶4。
C.同温同压下相同体积的N2气和CO气体含有相同物质的量、相同的质量和相同的对空气的密度。
D.相同温度下,气体的压强比等于气体体积的反比。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是_______________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1
d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:___________________________。
查看答案和解析>>
科目: 来源: 题型:
物质A~E中均含某种元素,都是中学化学中常见的物质,它们可发生如图所表示的反应(除A~E外的其它物质已略去):

(1)写出相应物质的类别:
| B | C | D | |
| 类别 |
查看答案和解析>>
科目: 来源: 题型:
铁及铁的化合物应用广泛,如 FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出 FeCl3溶液腐蚀印刷电路铜板的离子方程式。 。
(2)若将(1)中的反应设计成原电池,请补充右边原电池的装置图,在括号内填上正、负极的材料、电解质溶液,并写出电极反应式。正极反应
负极反应

(3)腐蚀铜板后的混合溶液中,若 Cu2+、Fe3+和 Fe2+的浓度均为 0.10mol.L-1,请参照下表给出的数据和药品,简述除去 CuCl2溶液中 Fe3+和Fe2+的实验步骤:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaCl-溶液 CuO Cu | ||
实验步骤:
查看答案和解析>>
科目: 来源: 题型:
在天平两边各放一只盛有相同浓度、相同体积的足量盐酸溶液的烧杯,调节天平到平衡,在左边烧杯中放入3.6的铝粉,为使天平最终保持平衡,右边烧杯中应放入镁粉的量是 ( )
A、3.49g B、3.60g C、3.81g D、3.92g
查看答案和解析>>
科目: 来源: 题型:
CH3CH2OH、CH3COOH和NaOH都是中学化学的常用试剂。请回答下列问题:
⑴①乙酸和甲酸甲酯互为同分异构体,但前者的熔点高于后者。原因是 。
②在油脂的皂化反应中,加入乙醇能加快反应的速率。原因是 。
③将在空气中灼烧成红热的铜丝伸入无水乙醇中,铜丝立即变为红色。请用化学方程式表示铜丝变红的原因 。
⑵用0.1mol/LNaOH溶液测定CH3COOH的物质的量浓度,碱式滴定管用标准溶液润洗后即加入标准溶液,经“必要”操作后,进行滴定。
①此处的“必要”操作是指 。
②选用的指示剂是 。
③滴点终点时溶液中离子浓度由大到小的顺序是 。
⑶无水醋酸钠和NaOH固体混合加热时能生成CH4,反应的化学方程式是 ,利用此反应制备CH4的装置与制备 相同。
⑷乙醇和乙酸在浓硫酸存在下反应生成具有香味的物质,反应的化学方程式是 。反应类型是 ,用浓硫酸作催化剂可能造成 等问题(答两条即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com