
科目: 来源: 题型:
某无色溶液中,若加入溴水,溴水褪色,若加入金属铝,铝溶解并产生大量氢气,则该溶液中可能大量存在的离子组是
A.Na+、OH—、S 2—、ClO— B.H+、Na+、Fe2+、NO3—
C.K+、Ba2+、OH—、SO32— D.Na+、K+、Ba2+、OH-
查看答案和解析>>
科目: 来源: 题型:
a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是
A.(b-2a)mol B.![]() b mol C.
b mol C.![]() a mol D.2a mol
a mol D.2a mol
查看答案和解析>>
科目: 来源: 题型:
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。
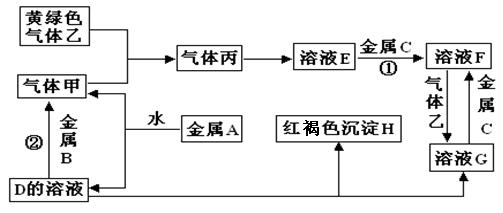
请根据以上信息回答下列问题:
写出下列物质的化学式:
A__________________;H _______________; G_____________;乙______________;
写出下列反应的化学方程式
反应①_________________________________________________________________
反应②_________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。

已知:
Ⅰ ![]()
Ⅱ ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
⑴x的化学式是 ;
⑵H的结构简式是___________________________;
⑶反应②的类型是 ;
⑷反应⑤的化学方程式是_________________________ _____;
⑸![]() 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;
⑹请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。
例:

查看答案和解析>>
科目: 来源: 题型:
14g Cu、Ag合金与足量某浓度的HNO3反应,将放出的气体与1.12 L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中Cu的质量为
A.9.6 g B.6.4 g C.3.2 g D.1.6 g
查看答案和解析>>
科目: 来源: 题型:
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池。下图是一个乙醇燃料电池工作时的示意图。乙池中的两个电极均为石墨电极,乙池中盛有100 mL3.00 mol/L的CuSO4溶液。请回答下列问题:
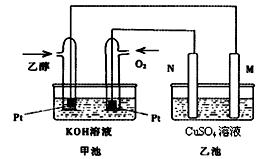
在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出30kJ热量,表示该反应的热化学方程式为 。
(2)N的电极反应式为 。
(3)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气 升
(标准状况下)
(4) 在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况![]() 下),理论上需通入乙醇 g?
下),理论上需通入乙醇 g?
查看答案和解析>>
科目: 来源: 题型:
2009年诺贝尔自然科学奖最后一个奖项——化学奖揭晓。来自美国、以色列的3位科学家因“对核糖体结构和功能的研究”而获奖。核糖体中只含两种成分:65%的核糖核酸(RNA)和35%的蛋白质,下列有关核糖核酸和核蛋白的说法不正确的是
A.RNA能透过半透膜 B.RNA能发生水解反应
C.核酸包括核糖核酸和脱氧核糖核酸两大类 D.核蛋白水解后能得到核酸
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式书写正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42ˉ=Ba SO4↓
B.将CO2通入稀Na2CO3溶液: CO2 + CO32ˉ+ H2O=2HCO3ˉ
C.氯气被冷的氢氧化钠溶液吸收: Cl2 + 2OHˉ=Clˉ+ ClO2ˉ+ H2
D.氢氧化铝与稀硫酸反应: OHˉ + H+= H2O
查看答案和解析>>
科目: 来源: 题型:
准确称取6.0 g铝土矿样品(含Fe2O3),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如右图所示。则所用硫酸物质的量浓度为
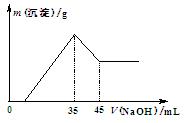
A.1.75 mol·L-1 B.3.50 mol·L-1 C.0.85 mol·L-1 D.无法确定
查看答案和解析>>
科目: 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
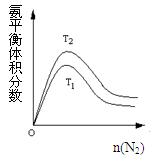
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),判断的依据是:
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) ![]() H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com