
科目: 来源: 题型:
NA代表阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,14 g N2含有的分子数为0.5NA
B.6.72L NO2与足量H2O反应,转移的电子数为0.1NA
C.0.1mol/L的NaOH溶液中含钠离子数为0.1NA
D.0.30mol Fe粉与足量水蒸气反应生成H2的物质的量为0.4NA
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F均为短周期元素;A、C具有相同的电子层数;E元素在B的下一周期;A与D同主族;原子半径大小为F>E>A>B>C。AC2常温下呈气态,通入紫色的石蕊溶液中会变红色,单质E可以在AC2中燃烧,发生置换反应。回答:
(1)AC2的分子构型为 ,E在AC2中燃烧的化学方程式为 。
(2)A、D的最高价氧化物熔点更高是 (填物质化学式),其理由是
。
(3)B、C、E、F均能形成简单离子,其半径由大到小的顺序为 。(用离子符号表示)
(4)F3B是一种离子化合物,能与水反应生成两种碱性物质。将F3B加入到足量的盐酸中,写出发生反应的离子方程式 。
(5)A、E两元素形成阴、阳离子质量比为1∶1的离子化合物能与水反应生成一种气体,此气体的结构式为 。
查看答案和解析>>
科目: 来源: 题型:
活性氧化锌常用作橡胶制品的硫化活性剂。工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)生产活性氧化锌,生产工艺流程如下:
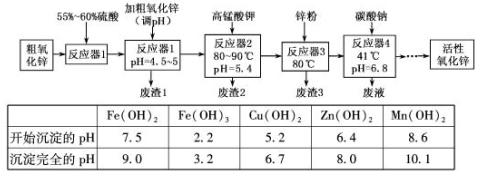
根据上表提供的信息,回答下列问题:
(1)“废渣1”的主要成分是 。
(2)完成“反应器2”中反应之一的离子方程式:
□MnO-4+□Mn2++□ =□MnO2↓+□H+
(3)蘸取“反应器2”中的溶液点在 试纸上,如果观察到试纸变蓝,说明KMnO4过量。
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)==2MnO(s)+CO2(g)△H=—174.6kJ·mol-1
C(s)+CO2(g)==2CO(g) △H=+283.0kJ·mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式: 。
(5)“反应器3”中加入锌粉的作用是 。
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有 。
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌。取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO20.224l,碱式碳酸锌的化学式
。
查看答案和解析>>
科目: 来源: 题型:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn ③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)基态原子Z 的电子排布式是 。
(2)在[Z(NH3)4]2+离子中, NH3提供 。
(3)QX2的电子式 ,一种由X和R组成的化合物与QX2互为等电子体,其化学式为 。
(4)比较X的氢化物与同主族相邻元素所形成的氢化物稳定性 ,(填化学式),并说明理由 。
查看答案和解析>>
科目: 来源: 题型:
下列递变情况中,正确的是
A.Na、Mg、Al原子的最外层电子数依次减少 B.Si、P、S元素的最高正价依次降低
C.C、N、O的原子半径依次减小 D.Li、Na、K的金属性依次减弱
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究。
甲同学设计了如下图所示的实验装置并进行实验:
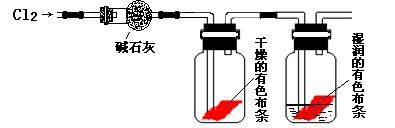
(1) 甲同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因
(2)甲同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是 ,由此得出Cl2使有色物质褪色的机理是 ![]() ;
;
(3)乙同学认为甲设计的实验装置即使改进后还缺少一装置。缺少的装置中发生的离子反应方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com