
科目: 来源: 题型:
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:

请回答下列问题:
硫酸与二氧化钛反应的化学方程式是____________________________________。
向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kg A(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
查看答案和解析>>
科目: 来源: 题型:
把500 ![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠
硫酸钠
的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯
硝酸银的溶液,恰好使氯
离子完全沉淀。则该混合溶液中钾离子浓度为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
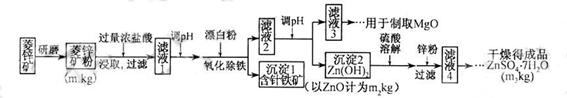
将菱锌矿研磨成粉的目的是_____。
完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目: 来源: 题型:
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(![]() )等化合物。
)等化合物。
1)三硅酸镁的氧化物形式为_______,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为_______。
2)铝元素的原子核外共有__ ___种不同运动状态的电子、_______种不同能级的电子。
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径____ (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:______
4)![]() 、Mg0和
、Mg0和![]() 都可以制耐火材料, 其原因是______。
都可以制耐火材料, 其原因是______。
a.![]() 、Mg0和
、Mg0和![]() 都不溶于水
都不溶于水
b.![]() 、Mg0和
、Mg0和![]() 都是白色固体
都是白色固体
c.![]() 、Mg0和
、Mg0和![]() 都是氧化物
都是氧化物
d.![]() 、Mg0和
、Mg0和![]() 都有很高的熔点
都有很高的熔点
查看答案和解析>>
科目: 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:

将菱锌矿研磨成粉的目的是_____。
完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
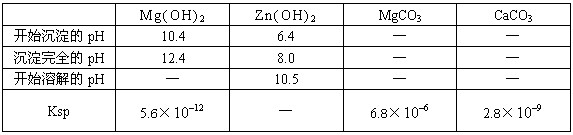
(4)根据下表数据,调节“滤液2”的ph时,理论上可选用的最大区间为______。
|
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6× | — | 6.8× | 2.8× |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目: 来源: 题型:
能在溶液中大量共存的一组离子是
A.NH4+ 、Ag+、PO43-、Cl- B.Fe3+、H+、I-、HCO3-
C.K+、Na+、NO3- 、MnO4- D.Al3+、Mg2+ 、SO42- 、CO32-
查看答案和解析>>
科目: 来源: 题型:
水是最宝贵的资源之一。下列表述正确的是
A.H2O的电子式为![]()
B.4℃时,纯水的pH=7
C.![]() 中,质量数之和是质子数之和的两倍
中,质量数之和是质子数之和的两倍
D.273K、101kPa,水分子间的平均距离![]() :
:![]() (气态)>
(气态)>![]() (液态)>
(液态)>![]() (固态)
(固态)
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式表达正确的是
A.用惰性电极电解熔融氯化钠:![]()
B.用氢氧化钠溶液除去铝表面的氧化膜:![]()
C.用稀氢氧化钠溶液吸收二氧化氮:![]()
D.用食醋除去水瓶中的水垢:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com