
科目: 来源: 题型:
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
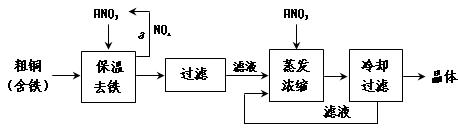
①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
(3)如图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
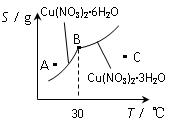
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c. 按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d. 若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O
晶体
查看答案和解析>>
科目: 来源: 题型:
( 14 分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍―镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:
 请回答下列问题:
请回答下列问题:
(1)镉元素位于周期表中第 周期,第 族,其原子结构示意图为 ;
(2)写出步骤①反应的离子方程式 。
(3)步骤②所加入的金属是 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
已知元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键。
Be(1.5)和F(4.0):____________,Si(1.8)和Cl(3.0):____________。
查看答案和解析>>
科目: 来源: 题型:
可逆反应2NO2 ![]() 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是 ①混合物各物质的量的浓度相等 ②单位时间内生成n mol O2 的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是 ①混合物各物质的量的浓度相等 ②单位时间内生成n mol O2 的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
A.①④ B.②④ C.①③④ D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,下列说法正确的是
A、18O只存在于乙酸乙酯中
B、18O存在于水、乙酸、乙醇以及乙酸乙酯中
C、18O存在于乙酸乙酯、乙醇中
D、若与丙酸反应生成的酯的相对分子质量为102
查看答案和解析>>
科目: 来源: 题型:
酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO3 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
① 计算吸收液中NaNO2和NaNO3物质的量之比。
② 1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
查看答案和解析>>
科目: 来源: 题型:
(每空2分,共16分)制取氨气并完成喷泉实验(图中夹持装置均已略去)。

(1)写出实验室制取氨气化学方程式 ;氨气分子是由 (填“极性”或“非极性”)键构成的 (填“极性”或“非极性”)分子;氨气的水溶液叫氨水,氨水显弱碱性的原因可用方程式表示为 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂;
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 ;该实验的原理是 ;
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
答:_________________________________________________________
___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
将Na2O和Na2O2组成的固体混合物溶于一定量的水中,充分反应后,收集到标准状况下的气体1.12L,同时得到0.6mol NaOH,请计算:
(1)原固体混合物中Na2O和Na2O2的质量;
(2)恰好中和所得溶液,需加入2.0 mol/L HCl溶液的体积。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com