
科目: 来源: 题型:
下列有关物质的性质或应用的说法不正确的是
A.二氧化硅是生产光纤制品的基本原料
B.水玻璃可用于生产黏合剂和防火剂
C.盐析可提纯蛋白质并保持其生理活性
D.石油分馏可获得乙烯、丙烯和丁二烯
查看答案和解析>>
科目: 来源: 题型:
下面关于SiO2晶体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:2
D.最小的环上,有6个Si原子和6个O原子
查看答案和解析>>
科目: 来源: 题型:
锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性小组对废旧锂离子电池正极材料(![]() 、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:

(1)第②步反应得到的沉淀X的化学式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤![]() 所需的玻璃仪器有 。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因: 、 。
所需的玻璃仪器有 。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因: 、 。
(4)若废旧锂离子电池正极材料含![]() 的质量为18.1g,第③步反应中加入20.0ml3.0mol.
的质量为18.1g,第③步反应中加入20.0ml3.0mol.![]() 的
的![]() 溶液,假定正极材料中的锂经反应③和④完全转化为
溶液,假定正极材料中的锂经反应③和④完全转化为![]() ,则至少有 g
,则至少有 g![]() 参加了反应。
参加了反应。
查看答案和解析>>
科目: 来源: 题型:
有机化合物A~H的转换关系如下所示:

请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是 ,名称是________________;
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是 ;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是 ;
(4)①的反应类型是___________;③的反应类型是________________
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B所有可能的结构简式
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式为 。
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A.在醋酸溶液的![]() ,将此溶液稀释1倍后,溶液的
,将此溶液稀释1倍后,溶液的![]() ,则
,则![]()
B.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
C.![]() 盐酸的
盐酸的![]() ,
,![]() 盐酸的
盐酸的![]()
D.若1mL![]() 的盐酸与100mL
的盐酸与100mL![]() 溶液混合后,溶液的
溶液混合后,溶液的![]() 则
则![]() 溶液的
溶液的![]()
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是( )
A.最外层有2个电子的原子都是金属原子
B.原子最外层电子数相同的元素,其单质的化学性质一定相似
C.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
D.溴元素位于周期表的第7纵行
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为P1。若控制容器的体积不变,加入足量的Na2O2,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2。则和P1和P2之间的关系是( )
A.P1=8P2 B.P1=4P2 C.P1=2P2 D.P1=P2
查看答案和解析>>
科目: 来源: 题型:
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出![]() 。
。
Ⅱ.将![]() 配制成溶液。www..com
配制成溶液。www..com
Ⅲ.![]() 溶液与稍过量的
溶液与稍过量的![]() 溶液混合,得到含
溶液混合,得到含![]() 的浊液,同时有CO2气体
的浊液,同时有CO2气体
放出。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到![]() 固体。
固体。
Ⅴ.煅烧![]() ,得到
,得到![]() 固体。
固体。
已知:![]() 在热水中分解。
在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的![]() ,该反应的离子方程式是 。
,该反应的离子方程式是 。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用 。
(3)Ⅲ中,生成![]() 的离子方程式是 。若
的离子方程式是 。若![]() 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)Ⅳ中,通过检验![]() 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验![]() 的操作是 。
的操作是 。
(5)已知锻炼![]() 的化学方程式是
的化学方程式是![]()
![]()
![]() 。现锻炼464.0kg
。现锻炼464.0kg
的![]() ,得到316.8kg产品。若产品中杂质只有
,得到316.8kg产品。若产品中杂质只有![]() ,则该产品中
,则该产品中![]() 的质量是
的质量是
kg。
查看答案和解析>>
科目: 来源: 题型:
 以黄铁矿为原料生产硫酸的工艺流程图如下:
以黄铁矿为原料生产硫酸的工艺流程图如下:
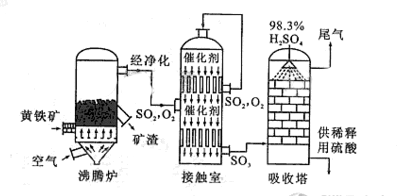
(1)将燃烧黄铁矿的化学方程式补充完整:
4_________+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是_________________________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高SO2的转化率
c. 使用催化剂能提高SO2的反应速率和转化率
d. 沸腾炉排出的矿渣可制造水泥或制砖,含铁品位高的矿渣可炼铁
(4)每160g SO3气体与液态H2O化合放出260.6kJ的热量,该反应的热化学方程式是
________________________________________________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是______________________________________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是____________%;
若铵盐质量为15.00g,浓硫酸增加的质量为________。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com