
科目: 来源: 题型:
提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
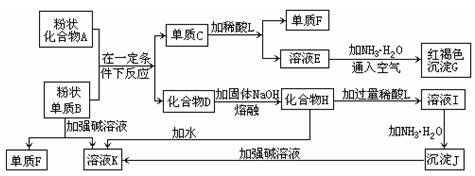
(1)单质F是_____________________。
(2)写出由E生成G的化学反应方程式或离子方程式 ___________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
查看答案和解析>>
科目: 来源: 题型:
在给定的溶液中,加入对应的一组离子,则该组离子能在原溶液中大量共存的
A.滴加甲基橙显红色的溶液:I-、NH4+、Cl-、NO3-
B.含有大量AlO2-的溶液:Na+、K+、NO3-、CO32-
C.常温下由水电离出来的c(H+)=10-13 mol/L的溶液: K+、HCO3-、Br-、Ba2+
D.含有溶质为NaHSO4的溶液: K+、SiO32-、NO3-、Al3+
查看答案和解析>>
科目: 来源: 题型:
在一定温度和体积的密闭容器中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)起始时N2和H2的浓度分别为1mol·L-1、4mol·L-1,2S末时,测定N2的浓度为0.8mol·L-1,则用H2的浓度变化表示的化学反应速率为
2NH3(g)起始时N2和H2的浓度分别为1mol·L-1、4mol·L-1,2S末时,测定N2的浓度为0.8mol·L-1,则用H2的浓度变化表示的化学反应速率为
A.0.1 mol·L-1·S-1 B.0.8 mol·L-1·S-1
C.0.3 mol·L-1·S-1 D.0.9 mol·L-1·S-1
查看答案和解析>>
科目: 来源: 题型:
![]() 在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g) +3D(g);△H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下:
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g) +3D(g);△H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下:

下列分析中不正确的是
A.图I可体现t0时升高温度对反应速率的影响
B.图II可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图III可体现催化剂对化学平衡的影响,且甲使用了催化剂
D.图III可体现温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目: 来源: 题型:
下列实验中,金属或固体可以完全溶解的是
A.在H2O2溶液中加入少量MnO2粉末
B.镀锌铁皮加入足量的NaOH溶液中
C.1mol铜片与含2molH2SO4的浓硫酸共热
D.常温下1mol铜片投入含4molHNO3的浓硝酸中
查看答案和解析>>
科目: 来源: 题型:
工业上由SiCl4制备高纯硅时,不使用钠、镁等活泼金属做还原剂,而是用氢气作还原剂其原因是
A.钠或镁等活泼金属的价格昂贵,成本高
B.钠或镁等活泼金属的还原性不及氢气强
C.钠或镁等金属可能与硅形成合金或残留在硅中
D.钠或镁的熔点没有硅高
查看答案和解析>>
科目: 来源: 题型:阅读理解
阅读下面两条科普信息,回答问题:
①一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,
而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚离
子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有于
人体吸收。
②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;
该反应的另一种反应物是CO2,反应后CO2转变成有机物甲醛:(用CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径
(1)能在人体进行Fe2+和Fe3+的转化,这说明亚铁离子具有 性,铁离子具有 性;
(2)服用维生素C,可以使食物中的Fe3+还原成Fe2+,这句话指出维生素C是
剂,具有 性;
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为 ;离子方程式为: 。
(4)第②条信息中的CO2做 剂,写出②中的离子方程式
。
查看答案和解析>>
科目: 来源: 题型:
已知A、B、C、D、E为原子序数依次增大的五种短周期元素。其中A与D、B与E同主族,C元素的最外层电子数是内层电子数的3倍,D元素在地壳中的含量仅次于氧,D的单质是良好的半导体材料,E元素的最高正价与最低负价的代数和为2。请回答:
(1)E元素的氢化物是 分子(填“极性”或“非极性”),电子式是 。
(2)A、B、C三种元素形成的氢化物的熔点由高到低的顺序是 。(用化学式表示)
(3)B、D、E三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是 。(用化学式表示)
(4)工业上用A单质制备D单质的化学方程式是 。
D和C形成的固体物质属于 晶体。
查看答案和解析>>
科目: 来源: 题型:
下列溶液中有关判断正确的是( )
A.常温下pH = 2的HA溶液与pH = 12的MOH溶液任意比混合:
C (H+) + c (M+) = c (OH-) + c (A-)
B.pH相等的CH3COONa、 NaOH和Na2CO3三种溶液:
C (NaOH) < c (CH3COONa) < c (Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
C (CH3COO-) + 2c (OH-) = 2c (H+) + c (CH3COOH)
D. 0.1 mol / L的NaHA溶液,其pH = 4:c (HA-) > c (H+) > c (H2A) > c (A2-)
查看答案和解析>>
科目: 来源: 题型:
2.0g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8 MnO4_ + 5 Cu2S + 44 H+ ==== 10 Cu2+ + 5 SO2 + 8 Mn2+ + 22 H2O
6 MnO4_ + 5 CuS + 28 H+ ==== 5 Cu2+ + 5 SO2 + 6 Mn2+ + 14 H2O
(1)上述两个反应具有完全相同的_____________(可多选)
A氧化剂 B还原剂 C氧化产物 D还原产物
(2) 反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.10 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
□MnO4_ + □Fe2+ + □H+ ——□Mn2++ □Fe3++ □_______
KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)混合物中Cu2S的质量分数为_________%。(写出解题过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com