
科目: 来源: 题型:
下列离子方程式正确的是
A.用石墨电极电解氯化铝溶液:Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用氯气给自来水消毒:Cl2+H2O=2H++Cl-+ClO-
C.用Na2CO3溶液作洗涤剂:CO32- +H2O![]() HCO3-+OH-
HCO3-+OH-
D.氮化镁加入过量稀盐酸中:Mg3N2 + 6H+ === 3Mg2+ + 2NH3↑
查看答案和解析>>
科目: 来源: 题型:
某温度下,密闭容器中,发生如下可逆反应:2E(g)![]() F(g)+xG(g);ΔH<0。若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5a mol/L;若E的起始浓度改为2a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
F(g)+xG(g);ΔH<0。若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5a mol/L;若E的起始浓度改为2a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
A.升高温度时,正反应速率加快、逆反应速率减慢
B.若x=l,容器体积保持不变,新平衡下E的体积分数为50%
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度为0.5a mol·L-1
D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol
查看答案和解析>>
科目: 来源: 题型:
已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈—1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
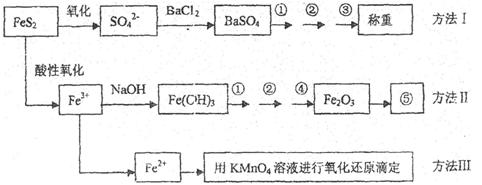
请同答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________、②___________、③________。
操作④、⑤用到的主要仪器是:④_________、⑤__________(每空填1~2个仪器)。
(2)判断溶液中SO42-离子己沉淀完全的方法是______________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
A、砝码生锈 B、定容时俯视
C、称量时物质和砝码位置反了(需要游码) D、容量瓶用待装液润
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________。
查看答案和解析>>
科目: 来源: 题型:
13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60 互为同素异形体
C.14N与15N互为同位素 D. 15N的核外电子数与中子数相同
查看答案和解析>>
科目: 来源: 题型:
在pH=13的无色溶液中,可以大量共存的一组离子是:( )
A.NH4+、NO3— 、K+、SO42— B.CO32_、NO3—、Al3+、Na+
C.Na+、ClO—、AlO2—、NO3— D.CrO42—、K+、Na+、SO42—
查看答案和解析>>
科目: 来源: 题型:
下列有关海水综合利用的说法正确的是( )
A.通过物理变化可以从海水中得到钾单质
B.利用潮汐发电是将化学能转化为电能
C.从海水中可得到NaCl,电解熔融NaCl可制备Na
D.海水蒸发制海盐的过程中只发生了化学变化
查看答案和解析>>
科目: 来源: 题型:
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A.2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(1);
O(1);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B.KOH(aq)+![]() H2 SO4(aq)=
H2 SO4(aq)= ![]() K2SO4(aq)+H
K2SO4(aq)+H![]() O(I);
O(I); ![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C.C8H18(I)+ ![]() O2(g)=8CO
O2(g)=8CO![]() (g)+ 9H2O;
(g)+ 9H2O; ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2 (g)+18H2O(1); ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
保持相同的温度,可逆反应2A(g(+B(g)![]() 2C(g)在1×105Pa和1×106Pa条件下分别达到平衡时的逆反应速率,后者与前者相比较 ( )
2C(g)在1×105Pa和1×106Pa条件下分别达到平衡时的逆反应速率,后者与前者相比较 ( )
A.大于 B.小于 C.等于 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com