
科目: 来源: 题型:
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
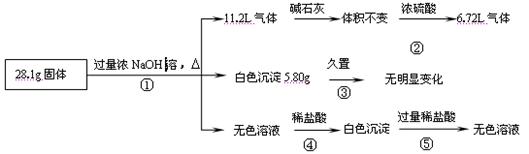
回答下列问题:
⑴混合物中是否存在FeCl2 _ __(填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 __ _(填“是”或“否”),你的判断依据是 。
⑶写出反应④的离子反应式: 。
⑷请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
。
⑸把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3结晶?
。
查看答案和解析>>
科目: 来源: 题型:
将表面已部分被氧化为氧化钠的金属钠样品5.4g放入40g水中,在标准状况下放出1.12LH2。求:
(1)产生H2的物质的量为多少?
(2)原混合物中金属钠的质量为多少克?
(3)若反应后溶液的体积为40mL,所得溶液的物质的量浓度为多少?
查看答案和解析>>
科目: 来源: 题型:
关于同温、同压下等体积的N2O和CO2的叙述:①质量相同;②所含碳原子数与氮原子数相等;③所含分子数相等,其中正确的是
A.①②③ B.②③ C.①② D.①③
查看答案和解析>>
科目: 来源: 题型:
.如果NO3-、Fe2+、SO42-、M四种离子以物质的量之比4∶2∶1∶2共存于同一溶液中,那么,M可能是
A.Cl— B.H+ C.Na+ D.Mg2+
查看答案和解析>>
科目: 来源: 题型:
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
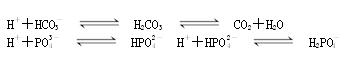
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减小,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,1 mol某气体若被O2完全氧化放热98.0 kJ,现有2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为
(注:某反应物的转化率=该反应物转化(消耗)的物质的量÷该反应物起始的物质的量×100%)
查看答案和解析>>
科目: 来源: 题型:
已知C(S,石墨) = C(S,金刚石) △H>0,下列判断正确的是( )
A.此反应为放热反应
B.断裂石墨的化学键需要吸收的能量小于形成金刚石的化学键放出的能量
C.石墨比金刚石稳定
D.此反应为物理变化
查看答案和解析>>
科目: 来源: 题型:
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体)。下列分析或结果不正确的是 ( )
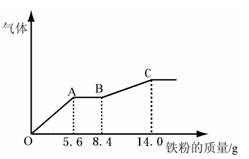
A.原混合酸中NO3-物质的量为0.2 mol
B.原混合酸中H2SO4浓度为2 mol·L-1
C.OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+, BC段产生的气体是氢气
D.第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目: 来源: 题型:
A、B、C、X均为中学化学中常见的纯净物,它们之间有如图所示的转化关系(副产物已略去)。
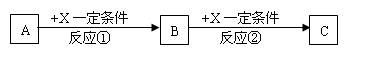
试回答:
(1)若X是强氧化性单质,则A可能是 。(填序号)
a、S b、Na c、Mg d、Al
(2)若X为金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在储存时应加入少量X,理由是(用离子方程式表示) 。
(3)若A、B、C为含同种金属元素的无机化合物,X为强酸或强碱。A和C在H2O溶液中反应生成B的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com