
科目: 来源: 题型:
已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应,且有气体产生,则该盐是
A.NaCl B.KNO3 C.Na2SO4 D.BaCl2
查看答案和解析>>
科目: 来源: 题型:
关于F、S、Cl的说法正确的是
A.非金属性:F > S > Cl B.原子半径:Cl > S > F
C.稳定性:HF > HCl > H2S D.酸性:HClO4 > H2SO4
查看答案和解析>>
科目: 来源: 题型:
某混合物粉末可能含有Al、Fe、FeO、Al2O3,某研究小组在实验室积极探究其组成。
(1)研究小组首先排除了含有单质Al的可能性,加入的试剂是_______(填序号)
A.硫酸 B.盐酸 C.氨水 D.氢氧化钠溶液
证明不含单质铝的现象是 。
(2) 该混合物的组成基本确定为Fe、FeO、Al2O3。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/L盐酸、3% H2O2、3mol/LCuSO4、蒸馏水。
根据你设计的实验方案,在答题卡上按下表的格式写出空白部分的实验操作、预期现象和结论。
| 实验操作 | 预期现象和结论 |
| 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。 | 粉末减少,说明粉末可能含有Al2O3 |
| 步骤2:取少量步骤1的滤液于试管中,逐滴滴加3mol/L盐酸至过量。 | _____________________________, 说明粉末中含有Al2O3。 |
| 步骤3:将步骤1的滤渣转移到烧杯B中,加入足量3mol/L CuSO4,充分搅拌,过滤,洗涤。 | 有红色固体生成,说明粉末中含有____。 |
| 步骤4:
|
|
查看答案和解析>>
科目: 来源: 题型:
下列实验操作正确且能达到预期目的的是
| 实验目的 | 操 作 | |
| 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 | |
| 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 | |
| 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 | |
| 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 | |
| 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu( NO3)2 的混合液 | |
| 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |
A.①⑤⑥ B.①②⑥ C.①③④ D.②④⑥
查看答案和解析>>
科目: 来源: 题型:
科学家一直致力于“人工固氮”的方法研究。
⑴目前合成氨的技术原理为:![]()
该反应的能量变化如图所示。
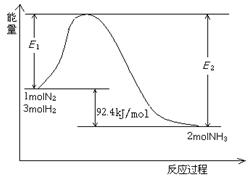
①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
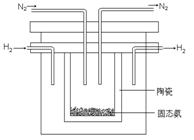
⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。
⑶根据最新“人工固氮”的研究报道,在常温、常 压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
![]()
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目: 来源: 题型:
下列反应属于氮的固定的是
A.空气在雷电作用下所产生NO
B.NO和O2生成NO2
C.铜与浓硝酸反应产生NO2
D.NH4Cl与Ca(OH)2反应生成NH3
查看答案和解析>>
科目: 来源: 题型:
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是
A. Fe2(SO4)3 B. Na2CO3 C. KNO3 D. FeSO4
查看答案和解析>>
科目: 来源: 题型:
某溶液中可能含有Na+、H+、CO32-、HCO3-、NO3-、SO42-、Cl-、OH-离子中的几种或全部,①取少量该溶液,加入过量氢氧化钡溶液,产生白色沉淀,该沉淀在盐酸中完全溶解;②另取少量该溶液,加入氯化铵并加热,有剌激性气味的气体X产生,该气体能使湿润的红色石蕊试纸变蓝;③在做②实验后的溶液中,加入硝酸酸化的硝酸银溶液,有白色沉淀产生。
(1)该溶液中肯定大量存在的离子为 ;
(2)写出②的离子方程式: 。
(3)X与第三周期所有非金属元素的氢化物比较,熔沸点偏高,原因是: 。
(4)与X含相同元素的另一简单化合物Y,其所含元素质量比为7:1或者1:7,1gY液态时完全燃烧,生成液态水和另一单质时,放出QkJ的热量,则Y燃烧的热化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com