
科目: 来源: 题型:
已知氧化还原反应:2Cu(IO3)2+24KI +12H2SO4=2CuI + 13I2+12K2SO4+12H2O,其中1摩尔氧化剂在反应中得到的电子为
A、10摩尔 B、11摩尔 C、12摩尔 D、13摩尔
查看答案和解析>>
科目: 来源: 题型:
D、E、X、Y、Z是短周期元素,且原子序数逐渐增大,D、E的最简单氢化物分子的空间结构依次是正四面体、三角锥型,X原子的最外层电子数是次外层电子数的一半,Y元素的最高正价和最低负价的代数和为4,Z元素的原子是所处周期中原子半径最小的。回答下列问题:
(1)D和Z形成的化合物的结构式是_________;D和Y形成的分子的名称是_ ___。
(2)Y和Z的简单离子的半径大小为__________(用离子符号和“>”、“=”或“<”表示)。
(3)比较元素非金属性的强弱有很多方法,关于D和X的非金属性强弱的研究方案中不可行的是_________(填序号)。
①比较氢化物的稳定性 ②依据两元素在周期表的位置 ③比较两种单质的颜色
④比较单质与H2化合的难易程度 ⑤比较最高价氧化物对应水化物的酸性
(4)当满足一定比例时,Z的单质可与E的最简单氢化物反应生成一种盐和另一种单质,试写出该反应的化学方程式________________________。
(5)写出下列反应的化学方程式:
①工业上用D的单质制X的单质___________________________________;
②E的最高价含氧酸的浓溶液与单质D反应__________________________。
(6)E有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则生成的E的含氧酸盐的化学式是__________。
查看答案和解析>>
科目: 来源: 题型:
下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④物质的熔点:石英>食盐>冰
A.①③ B.②④ C.①④ D.②③
查看答案和解析>>
科目: 来源: 题型:
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
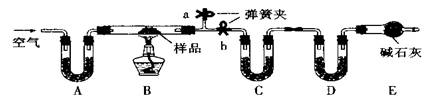
(1)实验时,B中发生反应的化学方程式为 , 。
(2)装置C、D中盛放的试剂分别为:
C ,D (供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是 ,它在该实验中的主要作用是
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 (填“偏高”、“偏低”或“无影响”)。
(5)反应前,在B装置中通入空气可减少实验误差,操作方法是 。
(6)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3·10H2O的质量分数为: 。
查看答案和解析>>
科目: 来源: 题型:
在2NO+O2![]() NO2 △H>0反应中,表明在30℃和100℃时平衡体系中NO的百分含量与反应体系总压强p的关系是下图中的
NO2 △H>0反应中,表明在30℃和100℃时平衡体系中NO的百分含量与反应体系总压强p的关系是下图中的
|