
科目: 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
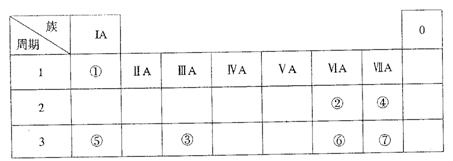
(1)④、⑤、⑦的原子半径由大到小的顺序为 。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为 。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
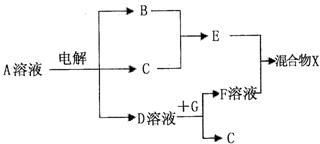
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为完全转化,则混合物x中含有的物质有 。
查看答案和解析>>
科目: 来源: 题型:
【化学—有机化学基础】
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2 ;有机物B与A相对分子质量相同,A和B之间能发生酯化反应,生成有机物C;B烃基上的一氯取代产物有3种。请回答下列问题:
(1)C的结构简式是 ______________________;
(2)有机物B在Cu作催化剂的条件下与O2 反应生成D,有机物E是D的氧化产物,F是E的一种同分异构体,F可发生如下图所示的转化,其中Y的分子式为C6H8O4且分子中含有一个由六个原子构成的环。
①写出F的结构简式_____________________
②写出由X生成Y的化学方程式________________________________________
③Z在一定条件下可以聚合生成高分子化合物,写出化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法来制备KMnO4。
 已知:①3MnO2+KClO3+6KOH
已知:①3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
②几种物质的溶解度:
| 温度 | 溶解度/g | ||
| K2CO3 | KOH | KMnO4 | |
| 20℃ | 111 | 112 | 6.38 |
| 60℃ | 127 | 154 | 22.1 |
请回答下列问题:
⑴第一步固体熔融时除三脚架、泥三角、细铁棒、坩埚钳外,还需下列仪器中的 ▲ 。
A.蒸发皿 B.烧杯 C.酒精灯 D.铁坩埚
 ⑵反应Ⅰ中氧化产物与还原产物的物质的量之比为 ▲ ;该反应中可以循环利用的产物是 ▲ 。
⑵反应Ⅰ中氧化产物与还原产物的物质的量之比为 ▲ ;该反应中可以循环利用的产物是 ▲ 。
⑶反应Ⅱ的条件为电解,写出反应Ⅱ的化学方程式 ▲ 。
⑷途径一、二中的操作a、b相同,均包括 ▲ 、过滤等3步。
⑸通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①实验时要将草酸晶体(H2C2O4·2H2O)配成标准溶液,则配制100mL1.5mol·L—1的草酸溶液,需要称取草酸晶体的质量为 ▲ 。
②该实验中除草酸晶体的质量外,还需要采集的数据有 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
镁—过氧化氢燃料电池具有比能量高、安全方便 等优点,
其结构示意图如图所示。
关于该电池的叙述正确的是
A.该电池可以在高温下正常工作
B.电池工作时,H+向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应式为:
Mg+H202+H2S04=MgS04+2H20
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是 ( )
A.用氨水洗涤附着银镜的试管
B.用CCl4作萃取剂直接从海带中提取I2
C.用向下排空气法收集NH3,并用湿润的蓝色石蕊试纸验满
D.制乙炔时滴加饱和食盐水是为了减缓电石与水的反应速率
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是 ( )
A.向AgCl悬浊液中加入足量的NaI溶液,无明显现象
B.CCI4和NH3两分子中各原子最外层均满足8电子结构
C.若短周期元素R2+和M+的电子层结构相同,则金属性R>M
D.标准状况下,N2和O2的混合气11.2L所含原子总数为![]()
查看答案和解析>>
科目: 来源: 题型:阅读理解
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)![]() 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)将水蒸气通过红热的炭即产生水煤气:
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
该反应在低温下能否自发 (填:能或否)。
(2)合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
(3)已知在400℃时,N2 (g)+ 3H2(g) ![]() 2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。
①在400℃时, 2NH3(g)![]() N2 (g)+ 3H2(g)的K= (填数值)。
N2 (g)+ 3H2(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。
③500℃、50MPa时,在容积为2L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
④在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号)。
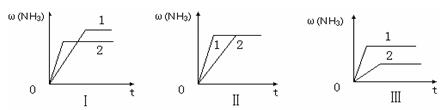
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能:1>2
查看答案和解析>>
科目: 来源: 题型:
已知有机分子中烯键可以在一定的条件下发生臭氧分解反应,例如:
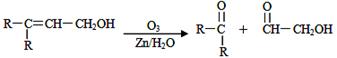 ,某有机物A的化学式是
,某有机物A的化学式是![]() ,它可以在一定条件下合成一种感光性高分子材料,该材料在微电子工业上具有重要用途.
,它可以在一定条件下合成一种感光性高分子材料,该材料在微电子工业上具有重要用途.

请回答:
(1) 指出下列反应的反应类型.反应II_____________;反应III_____________.
(2) 根据上述信息判断A中含有的官能团(或名称)______________________________.
(3) 写出下列物质的结构简式:C ;D______________.
(4) 写出反应III的化学反应方程式(必须用结构简式表示):
____________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是( )www..com
A.石油裂化的主要目的是提高乙烯的产量和质量
B.石油主要是由烷烃、环烷烃、芳香烃组成的混合物
C.石油的催化裂解是工业生产乙烯的重要环节
D.通过煤的干馏可获得少量芳香烃
查看答案和解析>>
科目: 来源: 题型:
常见的短周期元素A、B、C、D、E的原子序数依次增大。常温下,A、C可形成A2C2和A2C两种液态化合物,B原子最外层电子数是次外层电子数的2倍,D原子电子层数与最外层电子数相等,E与C同主族![]()
(1)写出B、D两元素的元素符号;B. D. 。
(2)上述五种元素中,非金属性最强的是 (填写元素名称),最高价氧化物对应水化物酸性最强的是 (写化学式)。
(3)元素D形成的简单离子的结构示意图为 。D的单质与第三周期A的同主族元素最高价氧化物对应水化物反应的离子方程式为 。
(4)B的单质与E的最高价氧化物对应水化物浓溶液共热反应的化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com