
科目: 来源: 题型:
向1.00 L0.3mol / L 的NaOH 溶液中缓慢通入0.2molCO2气体,使其完全反应,对反应后的溶液,下列判断正确的是
A.溶质只有Na2CO3 B.c(CO32-)> c(HCO3-)
C.c(OH-)>c(HCO3-) D.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)[
查看答案和解析>>
科目: 来源: 题型:
某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO- 、ClO3-的物质的量的量浓度比为3:1,则氯气与 NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为
A 2:1 B 11:3 C 3:1 D 4:1
查看答案和解析>>
科目: 来源: 题型:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。臭氧分子的结构如图,呈V型,两个O-O键的夹角为116.5??,三个原子以一个O原子为中心,与另外两个氧原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学健―三个O原子均等地享有这4个电子。(如图所示)。请回答:

(1)臭氧与氧气的关系是______________。
(2)选出下列分子与O3分子的结构最相似的是
A.H2O B.CO2 C.SO2 D.BeCl2
(3)O3具有强氧化性,它能氧化PbS为PbSO4,而O2不能,试配平:
_____PbS + _____O3 ——_____PbSO4 + _____O2
查看答案和解析>>
科目: 来源: 题型:
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中,不正确的是
A.1mol NH5中含有5 NA个N-H 键(NA表示阿伏伽德罗常数)
B. NH5中既有离子键又有共价键
C. NH5的熔沸点高于NH3
D.NH5固体投入水中的反应方程式是:NH4H+H2O=NH3·H2O+H2↑
查看答案和解析>>
科目: 来源: 题型:阅读理解
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。表1
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是 (填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”“中性”或“碱性”),理由是:
,
溶液中各离子浓度大小的关系是 。
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1_ K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正_ _ v(N2)逆(填写“>”、“=”或“<”)
查看答案和解析>>
科目: 来源: 题型:
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是 (填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的分子式为 。(写出2种即)
(3)与C同族、且位于第四周期元素所形成气态化物的电子式为 ,它属于 (填“极性”或“非极性”)分子,其沸点低于C的氢化物的沸点,主要原因是 。
(4)F的基态原子核外电子排布式是 。
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能 (填“大”或“小”)。
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可做储氢材料,该合金的晶胞如右图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为 。已知该晶体的密度为![]() ,其摩尔质量为
,其摩尔质量为![]() ,则该晶胞的体积是 。(请列出算式)
,则该晶胞的体积是 。(请列出算式)
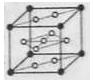
查看答案和解析>>
科目: 来源: 题型:
写出符合下列条件的短周期元素.(提示:答案可能有多种)
①.最外层电子数是次外层电子数的1/2的元素.___________ (填元素符号,下同)
②.最外层有2个电子的元素_________________
③.M层电子数是L层电子数的3/4的元素_____________
查看答案和解析>>
科目: 来源: 题型:
下列说法中错误的是
A.键长愈长,化学键愈不牢固
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.原子及其离子的核外电子层数均等于该元素所在的周期数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com