
科目: 来源: 题型:
判断物质中化学键时应该注意一些问题,下列说法中正确的是
①存在离子键的化合物一定是离子化合物,离子化合物中一定存在离子键
②离子化合物可以只含非金属元素,也可以存在共价键,如NH4Cl
③共价化合物中只含有共价键,不含离子键
④非金属单质(稀有气体除外)中只含有共价键
⑤稀有气体由单原子组成,无化学键
⑥只含有共价键的化合物一定是共价化合物,只含有共价键的物质不一定是共价化合物,可能是单质;含有共价键的化合物不一定是共价化合物,可能是离子化合物,例如NaOH
查看答案和解析>>
科目: 来源: 题型:
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
A.乙醇在电池的负极上参加反应 B.1mol CH3CH2OH被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极 D.电池正极的电极反应为4H++O2+4e—→2H2O
查看答案和解析>>
科目: 来源: 题型:阅读理解
阅读分析材料,据此完成下列要求
短周期元素A、B、C、D、E、F,它们的原子序数依次增大,其中B和C为同一周期;D、E、F为同一周期;A和D、C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2、X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
查看答案和解析>>
科目: 来源: 题型:
下列说法或表达正确的是 ( )
①次氯酸的电子式为![]()
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤将金属a与外加直流电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀
A.①③⑤ B.②④ C.①②③ D.④⑤
查看答案和解析>>
科目: 来源: 题型:
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列关于C3N4晶体的说法中正确的是( )
A.C3N4晶体是分子晶体
B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键结合
查看答案和解析>>
科目: 来源: 题型:
2009年5月18日,墨西哥流行病学与疾病控制中心负责人表示,检测到发生突变的甲型H1N1流感病毒。类似情况在美国和加拿大也被发现,这让学者非常担心,因为新病毒有可能具有更强的侵入性。下列说法正确的是
A、病毒侵入机体内经T细胞摄取处理,暴露出病毒所特有的抗原特性
B、效应T细胞能通过释放淋巴因子攻击被病毒入侵的细胞
C、患儿痊愈后若再次感染该病毒,相应的记忆细胞会迅速产生抗体消灭病毒
D、人体感染病毒后,需体液免疫和细胞免疫共同作用才可能彻底消除
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,A—J的所有物质之间有如下的转化关系(部分反应产物省略):
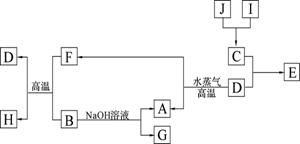
(1)B元素和C元素的简单离子半径大小关系是 (用离子符号表示): _;
(2)将氮元素与C形成的化合物NC3加入水中产生使红色石蕊试纸变蓝的气体,写出该反应的化学方程式 ;
(3)由E的饱和溶液滴入沸水中形成透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是______________ ___;
(4)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是__________________________________________________ _;
(5)向含有0.1 mol G的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g ,则加入盐酸的体积可能为______________________________(mL)。
查看答案和解析>>
科目: 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g) ![]() 2NH3(g) △H <O,673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g) △H <O,673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
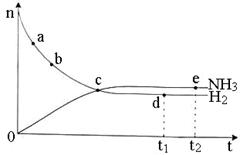
A.点b的正反应速率比点a的大 B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
查看答案和解析>>
科目: 来源: 题型:
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
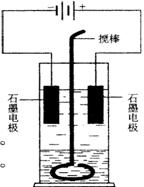
(1)阳极上的电极反应式为__________________________。
(2)阴极上的电极反应式为______________________________。
(3)原上层液体是_______________________________________。
(4)原下层液体是________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是_____________________
______________________________________________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是__________________________,
现象是_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com