
科目: 来源: 题型:
下列离子方程式中,正确的是
A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.硫酸溶液中加入少量Ba(OH)2溶液:SO42- + Ba2+= BaSO4
C.用稀硫酸洗去铁锈:Fe2O3+6H+=2Fe3++3H2O
D.硝酸汞溶液与铝反应:Hg2++Al=Al3++Hg
查看答案和解析>>
科目: 来源: 题型:
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中Ba2+恰好完全沉淀时,溶液pH=11,若反应后溶液体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1︰9 B.1︰1 C.1︰2 D.1︰4
查看答案和解析>>
科目: 来源: 题型:
某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)______25℃,理由是_________________________________________________,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b=_________;
(2)若所得混合溶液pH=2,则a:b=__________。
查看答案和解析>>
科目: 来源: 题型:
有A、B、C、D四种盐,组成它们的阳离子有:Ba2+、Ag+、Na+、Cu2+中,阴离子有:NO3-、Cl-、SO42-、CO32-。某同学设计实验对它们进行鉴别:
⑴ 把四种盐分别溶解于盛有蒸馏水的四支试管中,均得到澄清溶液。通过观察及分析,该同学得出如下结论:
①可以确定的是A,则A为: (填化学式,下同);
②另三盐分别是: 、 、 ,但不知道分别对应哪种物质。
⑵ 再向未确定的三支试管中分别加入盐酸,则B盐溶液有沉淀产生,C盐溶液有无色无味气体产生。该同学确定另三种盐的化学式分别为:
B_____________,C_____________,D_______________。
⑶ 请你帮该同学完成下列反应的离子方程式:
B+盐酸:
C+盐酸:
A与D混合:
查看答案和解析>>
科目: 来源: 题型:
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的
主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
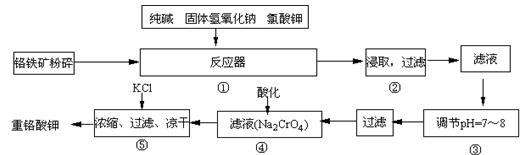
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式: 。
(2)操作③的目的是什么,用简要的文字说明: 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL
2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是: ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应) 。
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式书写正确的是
A.氯化钙溶液与碳酸钠溶液反应:Ca2++CO32- = CaCO3↓
B.氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42- = BaSO4↓
C.铁与稀硫酸反应:2Fe + 6H+ = 3H2↑+ 2Fe3+
D.氢氧化镁与稀盐酸反应:Mg(OH)2 + 2 H+ = Mg2+ + 2H2O
查看答案和解析>>
科目: 来源: 题型:阅读理解
原子序数由小到大排列的五种短周期元素X、Y、Z、M、W,其中X、Z、M、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,元素Y原子的最外层电子数是其电子层数的2倍,Z、M左右相邻,M、W位于同主族。
(1)元素W在周期表中的位置是 。W的阴离子结构示意图是 ;
(2)元素Z的单质的电子式为 。标况下,试管中收集满Z的氢化物,倒立于水中(溶质不扩散),一段时间后,试管内溶液的物质的量浓度为 。
(3)元素Y常见的同素异形体有 。 Y最高价氧化物中的化学键类型为 。Y的氢化物中含氢量最高的物质是常见的燃料,1g该燃料燃烧产生CO2(g)和H2O(l)时放热55.6kJ,试写出表示该燃料燃烧热的热化学反应方程式
。
(4)由X、Z、M、W四种元素中的三种组成的一种强酸,该酸的稀溶液能与铜反应,离子方程式为 。
(5)由X、Z、、M、W和Fe五种元素组成的摩尔质量为392g/ mol的化合物甲,1 mol甲中含有6mol结晶水。对化合物甲进行如下实验:
a.取甲的溶液加入过量的浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取甲的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①甲的化学式为 。
② 已知100mL 1 mol/L 的甲溶液能与20mL 1 mol/L的酸性KMnO4溶液恰好反应。写出反应的离子方程式 。
查看答案和解析>>
科目: 来源: 题型:
用48 mL 0.1 mol/L的FeSO4溶液,恰好还原2.4×10-3 mol[RO(OH)2]+离子,则R元素的最终价态为
A.+1 B.+2 C.+3 D.+4
查看答案和解析>>
科目: 来源: 题型:
一定量的液态化合物XY2在一定量的氧气中恰好完全燃烧,生成两种气态产物,反应的化学方程式为:XY2 + 3O2 ══ XO2 + 2YO2 ,冷却后,在标准状况下测得生成物的体积为672mL,密度为2.56g/L ,则:
(1)反应前O2的体积是 ;XY2的质量是 (保留小数点后两位)。
(2)化合物XY2的摩尔质量是 。
(3)若XY2分子中X、Y两元素的质量比为3∶16,则X、Y两元素名称分别是 和 。
查看答案和解析>>
科目: 来源: 题型:
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.1 mol NH3所含有的原子数为NA
B.标准状况下,22.4L H2O含有的分子数为NA
C.常温常压下,48g O3所含的氧原子数为3NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com