
科目: 来源: 题型:
氯气跟碘在加热条件下,以等物质的量进行反应,可得到一种红棕色液体ICl。ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式为:2ICl+2Zn===ZnCl2+ZnI2 ICl+H2O===HCl+HIO
下列叙述中正确的是
A.ZnCl2既是氧化产物,又是还原产物?
B.ICl跟H2O的反应是自身氧化还原反应?
C.ZnI2既是氧化产物,又是还原产物?
D.在ICl跟H2O的反应中,ICl是氧化剂,H2O是还原剂
查看答案和解析>>
科目: 来源: 题型:
根据下列事实,判断离子的氧化性顺序为①A+B2+ A2++B ②D+2H2O D(OH)2+H2↑
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+
A.D2+>A2+>B2+>E2+ B.D2+>E2+>A2+>B2+ C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
查看答案和解析>>
科目: 来源: 题型:
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
CH4的转化率与温度、压强的关系如右图。
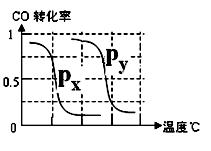
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) ![]() CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
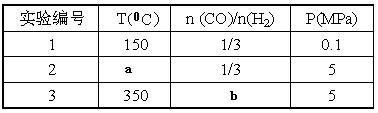
A.则上表中剩余的实验条件数据:a=________ b=_______
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
查看答案和解析>>
科目: 来源: 题型:
下列关于有机物的说法正确的是 ( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、蛋白质完全水解的产物互为同分异构体
C.石油裂解和油脂皂化都有高分子生成小分子的过程
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
查看答案和解析>>
科目: 来源: 题型:
在原电池和电解池的电极上所发生的反应,属于氧化反应的是
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
查看答案和解析>>
科目: 来源: 题型:
阿伏加德罗常数的值约为6.02×1023mol-1,下列叙述中不正确的是( )
①12.4g白磷晶体中含有的P-P键数约是0.6×6.02×1023
②0.5 mol·L—1 Mg(NO3) 2溶液中含有NO![]() 的数目为2NA
的数目为2NA
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1×6.02×1023
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2×6.02×1023
⑤Fe与0.1 mol氯气反应时失去的电子数为0.3 NA
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
A.① ④ ⑥ B.① ③ ④ ⑤ ⑥ C.② ③ ⑤ ⑥ D.③ ④ ⑤ ⑥
查看答案和解析>>
科目: 来源: 题型:
如图是课外活动小组的同学设计的4个喷泉实验方案.下列有关操作不可能引发喷泉现象的是
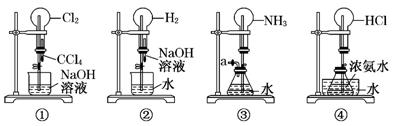
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
科目: 来源: 题型:
能正确表示下列反应的离子方程式是 ( )
A.将Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+=Fe3++3H2O
B.NaHCO3溶液水解:HCO3-+H2O ![]() CO32-+H3O+
CO32-+H3O+
C.用浓硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D .向Ba(HCO3)2溶液中加入少量的NaOH溶液 Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O
查看答案和解析>>
科目: 来源: 题型:
某无色透明溶液,在酸性环境下能大量共存的离子组是
A.Na+、SO42-、HCO3-、C1-
B.Mg2+、Cl-、Na+、NO3-
C.K+、MnO4-、NO3-、Fe2+
D.Cu2+、Cl-、NH4+、SO42-
查看答案和解析>>
科目: 来源: 题型:
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)
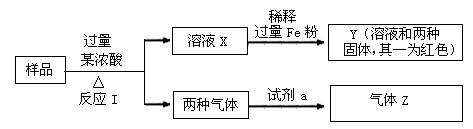
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式) ▲ 。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是 ▲ 。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是 ▲ 。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)
▲ 。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是 ▲ 。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示) ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com