
科目: 来源: 题型:
下列叙述正确的是
A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
B.2SO2(g) + O2(g)![]() 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用右图表示
2SO3(g)的正、逆反应的平衡常数K随温度的变化可用右图表示

C.2NO+2CO![]() 2CO2+N2 的△H<0,则该反应一定能自发进行
2CO2+N2 的△H<0,则该反应一定能自发进行
D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大
查看答案和解析>>
科目: 来源: 题型:
室温时,把10 mL pH=10的强碱溶液小心地加入到10 mL pH=4的某酸溶液中,在完全反应后的溶液中滴入紫色的石蕊试液时,溶液显红色,则此酸为 ( )
A. 一元强酸 B. 二元强酸 C. 任何强酸 D. 弱酸
查看答案和解析>>
科目: 来源: 题型:
纯碱一直以来都是工业生产的重要原料,很长一段时间来纯碱的制法都被欧美国家所垄断。上个世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法)。并在天津建造了我国独立研发的第一家制碱厂。其制碱原理的流程如下:
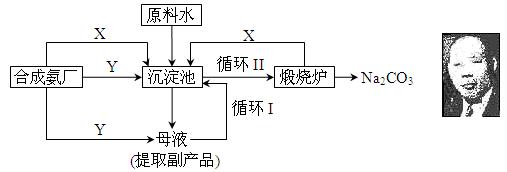
⑴侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明) 、 。
⑵合成氨工厂需要向制碱厂提供两种原料气体,它们分别是: 、 。(填化学式)这两种气体在使用过程中是否需要考虑添加的顺序: (填“是”或“否”),原因是: 。
⑶在沉淀池中发生的反应的化学方程式是: 。
⑷使原料水中溶质的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从母液中可以提取的副产品的应用是 (举一例)。
查看答案和解析>>
科目: 来源: 题型:
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中大量存在的离子有
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
查看答案和解析>>
科目: 来源: 题型:阅读理解
2009年12月7日~18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议。而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:

从反应开始到平衡,氢气的平均反应速
![]() (H2)=_______。
(H2)=_______。
②下列措施中一定不能使![]() (CH3OH)/ (CO2)增大的是_____。
(CH3OH)/ (CO2)增大的是_____。
A.降低温度 B.缩小容器的容积
C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的电离平衡常数K=___________。(已知:10-5.6=2.5×10-6)。
HCO3-+H+的电离平衡常数K=___________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为
________________;
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处的通入的是_____________(填“乙醇”或“氧气”),b处电极上发生的电极反应是___________
__________________________________________。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_______。
查看答案和解析>>
科目: 来源: 题型:
某溶液中,可能存在NH4+、Fe2+、Br-、CO32-、I-、SO32- 6种离子中的几种。①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝色。根据以上实验事实推断,该溶液中肯定不存在的离子为
A.NH4+、Br-、CO32- B.NH4+、SO32-、I-
C.Fe2+、I-、SO32- D.Fe2+、CO32-、I-![]()
查看答案和解析>>
科目: 来源: 题型:
海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
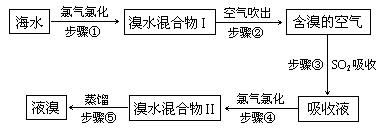
(1)步骤①反应的离子方程式是 。
(2)步骤③反应的化学方程式是 。
(3)Br的原子序数是 ,在周期表中位于 周期 族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因: 。
(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴? 。
查看答案和解析>>
科目: 来源: 题型:
下列各组解释合理的是 ( )
| 物质的检验、制备和用途及实验现象 | 解释 | |
| A | 在一定浓度的乙酸溶液中加入少量乙酸钠固体,溶液pH增大 | 完全是由于乙酸根水解所致 |
| B | 向少量未知溶液中滴加氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO2-4 |
| C | 常温下可用铁或铝制容器来盛装浓硫酸或浓硝酸 | 铁、铝表面发生了钝化现象 |
| D | 向饱和NaCl溶液中通入足量的NH3和CO2,有NaHCO3固体析出 | NaHCO3是难溶于水的盐 |
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式中正确的是( )
A.铜与热的浓硫酸:Cu+4H++SO42-![]() Cu2++SO2↑+2H2O
Cu2++SO2↑+2H2O
B.在碳酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH4++ OH-= NH3·H2O
C.用氨水吸收过量的二氧化硫:NH3·H2O+SO2=NH4++HSO3-
D.氯化亚铁溶液中加入硝酸:2Fe2++4H++NO3-=2Fe3++2H2O+NO↑
查看答案和解析>>
科目: 来源: 题型:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
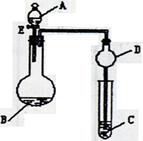
(1)图中D装置在实验中的作用是
(2)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是 ;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3(碘酸为强酸),写出该反应的离子反应方程式 。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是 ,C中发生反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com