
科目: 来源: 题型:
选择恰当的试剂和方法除去下列物质中的少量杂质(括号内为杂质)
(1)C2H6(C2H4)试剂__________,方法________________________________________。
(2)溴苯(溴)试剂__________,方法___________________________________________。
(3)苯(甲苯)试剂________,方法____________________________________________。
(4)溴化钠(溴)试剂__________,方法_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列关于NH4Cl的说法中不正确的是
A、氨气遇到HCl时,可以迅速反应生成NH4Cl
B、0.5molNH4Cl中含有氢原子的质量是2克
C、NH4Cl易溶于水,很稳定,受热不会分解
D、加热NH4Cl和碱的混合物,可以制取到氨气
查看答案和解析>>
科目: 来源: 题型:
在10ml 0.1mol/L NaOH溶液中加入等体积、等浓度的CH3COOH溶液,反应后溶液中各粒子的浓度关系错误的是
A、C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
B、C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
C、C(Na+)= C(CH3COO-)+C(CH3COOH)
D、C(Na+)+ C(H+)= C(CH3COO-)+C(OH-)
查看答案和解析>>
科目: 来源: 题型:
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
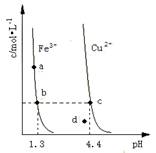
A. ![]()
B.加适量NH4Cl固体可使溶液由![]() 点变到
点变到![]() 点
点
C.![]()
![]() 两点代表的溶液中
两点代表的溶液中![]() 与
与![]() 乘积相等
乘积相等
D. Fe(OH)3、Cu(OH)2分别在![]() 、
、![]() 两点代表的溶液中达到饱和
两点代表的溶液中达到饱和
查看答案和解析>>
科目: 来源: 题型:
高纯六水氯化锶(SrCl2·6H2O)可用于制造高档磁性材料、电解金属钠的助熔剂、高档颜料和液晶玻璃等,具有很高的经济价值。高纯六水氯化锶的制备过程如下:
Ⅰ.将纯水加入烧杯内,搅拌下加入适量工业碳酸锶粉末(含少量Ba、Fe的化合物),制成浆料。
Ⅱ.缓慢加入工业盐酸进行酸化,将固体物质溶解。
Ⅲ.然后喷淋加入适量的硫酸,再加入质量分数为30%的双氧水少许。
Ⅳ.调节pH至8~10, 加热至60~70℃, ,搅拌1h,过滤,除去残渣。
Ⅴ.滤液加热至沸,继续浓缩至氯化锶质量浓度(溶质质量与溶液体积之比)为 x g/L。
请回答:
(1)用电子式表示HCl的形成过程 。
(2)已知Sr为第五周期第ⅡA族元素,则不符合Sr>Ca的是 (填序号)。
① 原子半径 ② 最外层电子数
③ 金属性 ④ 最高价氧化物对应的水化物的碱性
(3)写出步骤Ⅱ中加入盐酸时发生反应的离子方程式: 。
(4)加入硫酸后会先生成硫酸锶沉淀,进而转化为硫酸钡沉淀,试分析原理 。
(5)步骤Ⅲ中在酸性环境下加入双氧水是为将亚铁离子氧化成铁离子,写出该反应的离子方程式: 。
(6)步骤Ⅳ中调节pH至8~10,最好选用的试剂为 。
(7)已知某次实验得到浓缩后的氯化锶溶液中溶质为818g,溶剂为1000 g,经测定该溶液的密度为1.5 g/mL,则该溶液溶质的质量浓度x为 g/L(计算结果保留整数) 。
查看答案和解析>>
科目: 来源: 题型:
( 16分)活性ZnO俗称锌1-3,能改逬玻璃的化学稳定性,可用于生产特种玻璃,在橡胶的虫产屮能缩短硫化吋间,在涂料、油漆等工业也有重要应用。工业上由粗ZnO(含FeO、CuO等.)制备活性ZnO,采取酸浸、净化除杂、中和沉降、干燥煅烧等步骤,工艺流程如下:
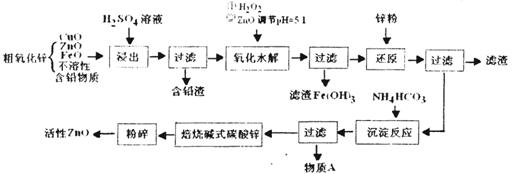
(1 )上述流程屮,浸出用的是60%H2SO4(1.5g/cm3),这种硫酸的物质的量浓度为________(保留两位小数)
(2 )已知ZnO为两性氧化物,与氢氧化钠溶液反应生成可溶性的锌酸盐(Zn02-),写出反应的离子方程式________________
(3) 写出加H2O2吋发生反应的离子方程式________________
(4) 除去Fe(OH)3后,在滤液中加入Zn的目的是________
(5) 上述流程中多次进行了过滤橾作,请写出过滤时用到的玻璃仪器:________________
(6) 物质A是________,检验该溶质阴离子的方法是________
(7) 取碱式碳酸锌6.82g,溶于盐酸生成C02 448mL(标准状况下),溶解过程消耗HCl 0. 12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com