
科目: 来源: 题型:
用NA表示阿伏加德罗常数,下列说法正确的是 ( )
①18g D2O含有的电子数为10NA;②1mol Na2O2与水完全反应时转移电子数为2NA ;③三硫化四磷分子中没有不饱和键,且各原子的最外层均已达到了八个电子的结构。在1mol三硫化四磷分子中含有的共价键数是9NA ;④在标准状况下,22.4LSO3的物质的量为1mol;⑤6.2g氧化钠和7.8g过氧化钠混合物中所含有的离子数约为0.6×6.02×1023
A.②④ B.③⑤ C ①②③ D.①④⑤
查看答案和解析>>
科目: 来源: 题型:
下列叙述中正确的是: ( )
A.原子晶体中,共价键的键能越大,熔沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
查看答案和解析>>
科目: 来源: 题型:
下图一是人类某一类型高胆固醇血症的分子基础示意图(控制该性状的基因位于常染色体上,以D和d表示)。根据有关知识回答下列问题:
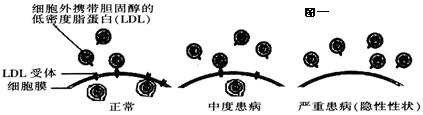
(1)控制LDL受体合成的是____性基因,基因型为________的人血液中胆固醇含量高于正常人。
(2)由图一可知携带胆固醇的低密度脂蛋白(LDL)进入细胞的方式是______,这体现了细胞膜具有____________的特点。
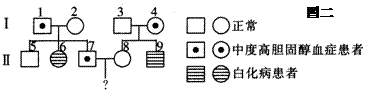
(3)下图二是对该高胆固醇血症和白化病患者家庭的调查情况,Ⅱ7与Ⅱ8生一个同时患这两种病的孩子的几率是____,为避免生下患这两种病的孩子,Ⅱ8必需进行的产前诊断方法是________。若Ⅱ7和Ⅱ8生了一个患严重高胆固醇血症的孩子,其最可能原因是发生了________。
查看答案和解析>>
科目: 来源: 题型:
为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_____________、 。
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
| 实验操作 | 现象 | 结论 |
| 步骤一: | 产生蓝色沉淀 | |
| 步骤二: | “猜想二”成立 |
查看答案和解析>>
科目: 来源: 题型:
在一个固定体积的密闭容器中,通入3 L X 气和2 L Y 气,在一定条件下发生下列反应:4X(g)+3Y(g) ![]() 2Q(g)+nR(g).反应达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值为
2Q(g)+nR(g).反应达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目: 来源: 题型:
今有CH4、C2H6 、CO的混合气体100ml和过量的氧气混合后点燃,经充分干燥后,总体积比原来混合气少了145ml,再将剩余气体通过碱石灰,体积又减少了110ml。若最后剩余气体为45毫升。求原混合气中各组分的体积分数是多少?氧气的体积又是多少?
查看答案和解析>>
科目: 来源: 题型:
用铁片与稀硫酸制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.不用稀硫酸,改用18mol/L的硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
查看答案和解析>>
科目: 来源: 题型:
一定条件下,在体积为10 L的密闭容器中,2 mol A和2 mol B 进行反应:2A(g) +B(g) ![]() C(g),经60s达到平衡,生成0.6 mol C。下列说法正确的是
C(g),经60s达到平衡,生成0.6 mol C。下列说法正确的是
A.以A浓度变化表示的反应速率为0.002 mol·(L·s)-1
B.若增大压强,则物质B 的转化率减小
C.若升高温度,A的体积分数增大,则该反应的△H>0
D.将容器体积变为20 L,C的平衡浓度变为原来的1/2
查看答案和解析>>
科目: 来源: 题型:
下列框图中的A ~ K物质均为中学常见物质。已知B、D、E、L常温下为密度比空气大的气体,D、E为单质,其它为化合物。A和I都是常用的漂白剂,F的焰色反应呈黄色。F、G均能与L的水溶液反应放出B。请根据图示关系回答问题:

(1)F的俗名是______;K的电子式______。
(2)反应①~⑤中,属于氧化-还原反应的是______。
(3)反应④的离子方程式________________________。
反应③的化学方程式________________________。
(4)某单质能与H反应生成E,该反应的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
某温度下,向PH=6的纯水中加入一定量的盐酸,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述中不正确的是
A.将该盐酸温度降低,pH不变
B.该溶液的浓度c(HCl)=0.01 mol·L-1
C.该溶液中水电离产生的c(H+)=10-10 mol·L-1
D.该温度下加入等体积pH=12的NaOH溶液,即可恰好完全中和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com