
科目: 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
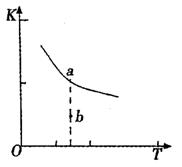
(1)某温度下,2SO2(g)+O2(g)![]() 2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正) v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正) v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
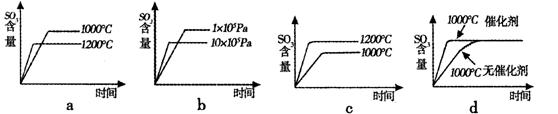
(2)若反应物起始的物质的量相同,下列关系图不正确的是 (填序号)。
(3)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeS04·7H2O),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到(NH4)2SO3和(NH4)2SO4两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO2-3)十c(HSO-3)+c(H2SO3)]=c(NH+4)+c(NH3·H2O)
请分析该同学的依据是 。
②在(NH4)2 SO4溶液中存在:NH+4+ H2O![]() NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1.7×10-5)
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1.7×10-5)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp(BaCO3)=1×10-9).
查看答案和解析>>
科目: 来源: 题型:
配制100mL 1mol/L NaCl溶液,下列操作中错误的是 ( )
A.在托盘天平上放两片大小一样的纸,然后将氯化钠放在纸片上称量
B.把称得的氯化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶
中
C.用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也移入容量瓶中
D.沿玻璃棒往容量瓶中加入蒸馏水,直至溶液凹液面恰好与刻度线相切
查看答案和解析>>
科目: 来源: 题型:
下列有关化学实验的叙述正确的是 ( )
A.用待测液润洗滴定用的锥形瓶
B.配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸
C.用稀盐酸洗涤盛放过石灰水的试剂瓶
D.Na2CO3溶液保存在带玻璃塞的试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
下列是几种原子的基态电子排布,电负性最大的原子是 ( )
A.1s22s22p4 B.1s22s22p63s23p3
C.ls22s22p63s23p2 C.ls22s22p63s23p64s2
查看答案和解析>>
科目: 来源: 题型:
纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
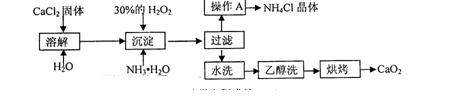
根据以上信息,同答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)操作A的步骤为 ;
(3)检验“水洗”已经洗净的方法是 ;
(4)测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI品体,再滴入适量2 mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ;
②产品中CaO2的质量分数为 (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
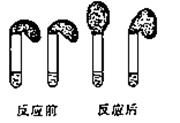
甲:①准确配制0.1mol·L-1的HA、HCl溶液各100mL;
②取纯度相同,质量、大小相等的锌粒放入两只试管中,同时加入0.1mol·L-1的HA、HCl溶液各100mL,按上图装好,观察现象。
乙:①用pH计测定物质的量浓度均为0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴约为![]() )分别稀释至100mL,
)分别稀释至100mL,
再用pH计测其pH变化。
(1)乙方案中说明HA是弱电解质的理由是,测得0.1mol·L-1的HA溶液的pH 1(填“>”“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是 。
A.装HCl的试管中放出的氢气速率大
B.装HA溶液的试管中放出氢气的速率大
C.两个试管中产生气体速率一样大
(2)乙同学设计的实验第②步,能证明改变条件解质平衡发生移动。加水稀释,弱酸HA的电离程度 (填“增大、减小、不变”)
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:使HA的电离程度和c(H+)都减小,c(A)增大,可在0.1mol·L-1的HA溶液中,选择加入 试剂。
A.NaA固体(可完全溶于水) B.1mol·L-1NaOH溶液
C.1mol·L-1H2SO4 D.2mol·L-1HA
(4)pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如右图所示,则下列说法不正确的有
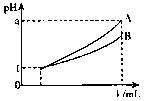
A.若a=4,则A是强酸,B是弱酸
B.若![]() ,则A、B都是弱酸
,则A、B都是弱酸
C.两种酸溶液的物质的量尝试一定相等
D.稀释后,A溶液的酸性比B溶液弱
查看答案和解析>>
科目: 来源: 题型:
右图为冰晶体的结构模型,大球代表O原子,小球代表H原子。下列有关说法正确的是( )

A.冰晶体熔化时,水分子之间的空隙增大
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H-O键形成冰晶体
D.冰晶体中每个水分子与另外四个水分子形成四面体
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
查看答案和解析>>
科目: 来源: 题型:
有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数。若按X→Y→Z的顺序,下列说法中正确的是 ( )
A.它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B.它们的原子半径依次增大
C.它们的单质在常温、常压下的密度依次减小
D.它们的最高价氧化物的水化物都是强电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com