
科目: 来源: 题型:
Ⅰ.某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
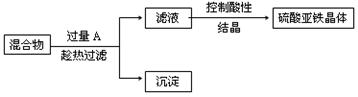
请根据题目要求回答下列问题:
(1)趁热过滤的目的是 。
(2)加入过量A,溶液中发生的离子方程式有 。
(3)结晶操作过程中应控制滤液酸性的原因是 ,结晶析出晶体后,用过滤的方法从溶液得到晶体,洗涤晶体的实验操作是 。
(4)实验室利用硫酸亚铁溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出该反应的离子方程式 。
Ⅱ.草酸亚铁晶体(FeC2O4·2H2O,相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
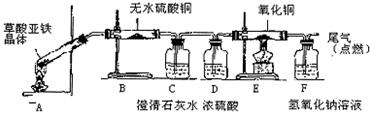
(5)该装置中最不合理的部分__________(填字母),原因是__________________________。
(6)写出B、C处的现象___________________________________________。
(7)当72.0g FeC2O4·2H2O完全反应后,残留混合物质量为27.2g,无水硫酸铜增重14.4g,C装置增重22.0g。求残留混合物的成分和物质的量 。(假设每个实验装置的药品足量,气体被充分吸收)
查看答案和解析>>
科目: 来源: 题型:
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是
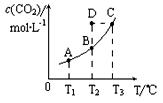
A.反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H>0
CO2(g)+H2(g)的△H>0
B.在T2时,若反应进行到状态D,则一定有v正<v逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目: 来源: 题型:
已知25℃时,AgⅠ饱和溶液中c(Ag+)为1.22×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是
A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
B.溶液中先产生的是AgI沉淀
C.AgCl的KSP的数值为1.69×10-10
D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。 请完成以下实验设计表:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响。 |
| ② | 298 | |||
| ③ | ||||
| ④ |
查看答案和解析>>
科目: 来源: 题型:
下列化学用语书写正确的是( )
A.氯原子的结构示意图:![]()
B.作为相对原子质量测定标准的碳核素:![]()
C.氯化镁的电子式:![]()
D.用电子式表示氯化氢分子的形成过程:![]()
查看答案和解析>>
科目: 来源: 题型:
有一包白色固体粉末,可能含有Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的一种或几种,按以下步骤进行实验:(1)将固体粉末溶于水得无色溶液和白色沉淀;(2)加入稀盐酸,沉淀部分溶解且有气泡产生。根据以上实验所产生得现象,判断这种混合物里,一定含有的物质是___________,一定没有的物质是__________,可能有的物质是__________。请设计实验证明可能有的物质__________________。
查看答案和解析>>
科目: 来源: 题型:
m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4。将反应后的混合气体完全燃烧,生成CO2和H2O,所需要氧气的物质的是( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com