
科目: 来源: 题型:
根据下列实验装置及现象,可以得到相应结论的是
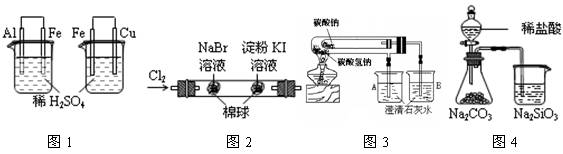
| 实验现象 | 结论 | |
| A | 图1左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 图2左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 图3左边烧杯变浑浊,右边烧杯不变浑浊 | 热稳定性:Na2CO3>NaHCO3 |
| D | 图4锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.第ⅥIA族元素从上到下,其氢化物的还原性依次减弱
B.同周期从左到右,非金属元素最高价氧化物对应的水化物的酸性依次增强
C.第三周期元素的离子半径从左到右逐渐减小
D.CCl4属于共价化合物,每个原子都满足8电子结构,其水溶液能导电
查看答案和解析>>
科目: 来源: 题型:
生活中处处有化学,下列有关说法正确的是
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯
C.地球上CH4、CO2等气体含量上升容易导致温室效应,进而引发灾难性气候
D.保鲜膜、一次性食品袋的主要成分是聚氯乙烯
查看答案和解析>>
科目: 来源: 题型:
在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01 mol·L-1,向溶液中逐滴加入0.01 mol·L-1AgNO3溶液时,最先和最后沉淀的物质是 ( )
(AgCl、 AgBr、 Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12)
A.AgBr、AgCl B.Ag2CrO4、AgCl
C.AgBr、Ag2CrO4 D.同时沉淀
查看答案和解析>>
科目: 来源: 题型:
常温下,pH=11的NaOH溶液aL分别与下列3种溶液混合,充分反应后使溶液呈中性:
①pH=3的醋酸bL;②物质的量浓度为1×10-3 mol/L的醋酸c L;③ c(OH-)=1×10-11 mol/L的H2SO4的溶液d L。判断a、b、c、d的大小关系,正确的是
| A.c>b>a=d | B. b>a=d>c |
| C. c>a>d>b | D. c>a=d>b |
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式中正确的是
A.在酸性硫酸亚铁溶液中加入过氧化氢:Fe2++H2O2+2H+=Fe3++2H2O
B.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
C.在含有Mn2+的溶液中加入HNO3,再加入PbO2,则反应体系显紫红色:
5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2HO
D.将数滴0.1 mol/L 盐酸溶液缓缓滴入1 mol/L 50mL Na2CO3溶液中,且不断搅拌:
2H++CO32-=CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
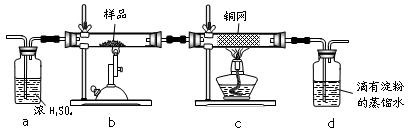
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的![]() 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:

(1)称量样品所用的仪器为_____,将样品研细后再反应,其目的是_______。
(2)装置A的作用是________。
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)滴定时,标准碘溶液所耗体积为_________mL。
判断滴定已达终点的现象是_______。
通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____。(填编号)
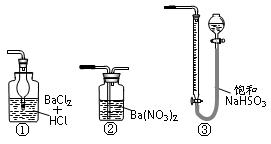
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列有关表述正确的是
⑴-OH 与![]() 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
⑵sp2杂化轨道:![]()
⑶Fe2+的离子结构示意图: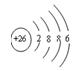
⑷CO2的分子模型示意图:![]()
⑸丙烷的分子结构模型示意图:![]()
⑹次氯酸的电子式为 ![]()
⑺ ![]() 名称为1,3-二甲基―2―丁 烯
名称为1,3-二甲基―2―丁 烯
⑻熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4—
⑼乙炔的最简式 CH≡CH
A.(1)(2)(4)(6) B.(2)(3)(5) C.(1)(4)(5)(8) D.(1)(2)(5)(8)
查看答案和解析>>
科目: 来源: 题型:阅读理解
测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成
I3-,并在溶液中建立如下平衡:I2 +I-![]() I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol·L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用_________做指示剂,滴定终点的现象是________。
(2)下列对该同学设计方案的分析,正确的是__________(填字母)。
A.方案可行。能准确测定溶液中的c(I2)
B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
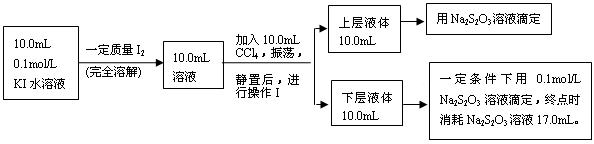
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即![]() 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是______(填名称)。
试指出该操作中应注意的事项为 。(任写一条)
(4)下层液体中碘单质的物质的量浓度是__________。
(5)实验测得上层溶液中c(I3-)=0.049 mol·L-1,结合上述有关数据,计算室温条件下反应I2+I-![]() I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com