
科目: 来源: 题型:
描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是
A.6个碳原子有可能都在一条直线上 B.6个碳原子连接起来呈现连续的多个锯齿状
C.6个碳原子一定都在同一平面上 D.在同一平面上最多可有12个原子
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素符号为 ▲ ;M在元素周期表中的位置为 ▲ ;五种元素的原子半径从大到小的顺序是 ▲ (用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ▲ ,B的结构式为 ▲ 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ▲ 。
(4)写出由X、Z、L三种元素组成的离子化合物与稀NaOH溶液反应的离子方程式:
▲ 。
(5)Z2H4和ZO2是一种双组分火箭推进剂。两种物质混合发生反应生成Z2和X2O(g),已知8g气体Z2H4在上述反应中放出142kJ热量,其热化学方程式为 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
(10分)已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 ___(填“>”、“<”或“=”)570 kJ
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量
的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4 完全燃烧生成CO2
气体和H2O(l)的热化学方程式为 ____________________________________ 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极
均由多孔的碳块组成。

该电池的正极为:__________(填A或B)。若该电池工作时增加了1mol H2O,电
路中转移电子的物质的量为 ____________ 。
(4)如果将上述装置中通往的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KKOH=K2CO3+3H2O,则该电池的负极反应式为:
______________________________________。
查看答案和解析>>
科目: 来源: 题型:
元素性质呈周期性变化的决定因素是( )
A.元素原子相对质量依次递增
B.元素原子半径大小呈周期性变化
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目: 来源: 题型:
可逆反应,C(s)+H2O![]() CO(g)+H2(g);△H>0,下列说法正确的是( )
CO(g)+H2(g);△H>0,下列说法正确的是( )
A. 达到平衡时,反应物的浓度和生成物的浓度相等
B. 达到平衡时,反应物和生成物的浓度不随时间的变化而变化
C. 由于反应前后分子数相等,所以增加压力对平衡没有影响
D.加入正催化剂可以加快反应达到平衡的速度
查看答案和解析>>
科目: 来源: 题型:
绿色材料是指与生态环境和谐共存并有利于人类健康的材料,被定为21世纪人类要实现的目标之一,包括循环材料、净化材料、绿色能源材料和绿色建材,下列有关绿色材料叙述中不正确的是( )
A.再生纸、再生塑料、再生金属及循环利用混凝土等是利用固体废物制造、再生循环制备和使用的循环材料
B.美国研制尾气催化剂材料可把汽车尾气中有害气体NOX、CO、碳氢化合物转化为N2、CO2和H2O,此催化剂材料是一种净化材料
C.太阳能、风能、水能、潮汐能及地热、垃圾发电等的开发和利用,这些洁净能源是绿色能源材料
D.建筑材料中的墙体和水泥,其原料来源于土地,是绿色建材
查看答案和解析>>
科目: 来源: 题型:
巴豆酸的结构简式为CH3—CH=CH—COOH。现有①氯化氢、②溴水、
③纯碱溶液、④丁醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是
A.只有②④⑤ B.只有①③④
C.只有①②③④ D.全部
查看答案和解析>>
科目: 来源: 题型:
(1)我国盛产稀土,17种稀土元素的性质非常接近,用有机萃取剂来分离稀土元素是一种重要的技术。化合物A就是其中的一种,其结构简式如下:
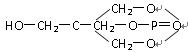
根据你所学的知识判断A属于( )
A.酸类 B.酯类 C.醛类 D.酚类
(2)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出苯的一种含叁键且无支链的同分异构体的结构简式______________________________________。
(3)烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系:
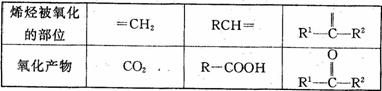
已知某烯烃的化学式为C5 H10 ,它与酸性高锰酸钾溶液反应后得到的产物若为二氧化碳和丁酮![]() ,则此烯烃的结构简式是 。
,则此烯烃的结构简式是 。
(4)环烷烃可以与卤素单质,卤化氢发生开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为 (不需注明反应条件)。
(5)写出有机物的名称
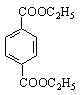
(6)为验证乙炔与溴的反应是加成而不是取代,某同学提出可用pH试纸来测试反应后溶液的酸性,理由是 。
查看答案和解析>>
科目: 来源: 题型:
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
(1)两套装置中的A、B处都需加热,
A处用水浴加热,B处用 ▲ 加热,A处用水浴加热的主要优点是 ▲ 。
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是 ▲ ,
B中反应的化学方程式为 ▲ 。
(3)若按乙装置进行实验,则B管中应装 ▲ ,B中反应的化学方程式为 ▲ 。
(4)实验完成时先打开D处的铁夹,再撤去酒精灯,试说明这样做的目的是 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
)如图是氯化钠的晶胞示意图,回答如下问题:
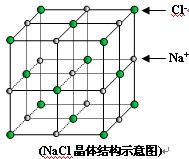
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
(2)NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,强热使其气化,测的气体体积为5.6 L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取a g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒 B.烧杯 C.容量瓶 D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为b cm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。(用含V、a、b的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com