
科目: 来源: 题型:
下列叙述正确的是 ( )
A.0.1mol·L—1氨水中,c(OH—)=c(NH4+)
B.10mL 0.02mol·L—1 HCl溶液与10mL 0.02mol·L—1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol·L—1 CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+)
D.0.1mol·L—1某二元弱酸碱性NaHA溶液中,c(Na+)=2c(A2—)+c(HA—)+c(H2A)
查看答案和解析>>
科目: 来源: 题型:
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)经验规律:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AIBr3中的化学键类型是 。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系 。
简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系
。
(3)某化合物分子中含有S-N键,该共用电子对偏向于 原子(填元素符号)。
查看答案和解析>>
科目: 来源: 题型:阅读理解
硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式 ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 。
(2)测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜品体受热可以逐步失去结品水,温度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
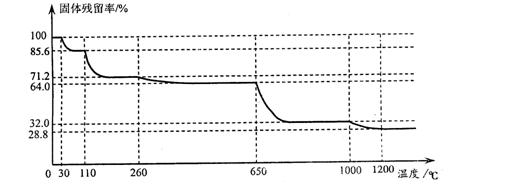
在110℃时所得固体的成分为 ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 。(填字母)
A.0 mol B.0.1mol C.0.125mol D.大于0.125mol
查看答案和解析>>
科目: 来源: 题型:
25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。

(1)根据上图数据,写出该反应的化学方程式: ;此反应的平衡常数表达式K= ,从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
(3)下图表示此反应的反应速率v和时间t的关系图:
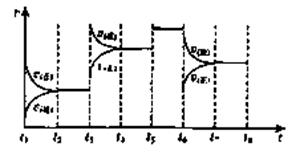
各阶段的平衡常数如下表所示:
|
|
|
|
|
|
|
|
|
|
K1、K2、K3、K4之间的关系为: (用“>”、“<”或“=”连接)A的转化率最大的一段时间是
查看答案和解析>>
科目: 来源: 题型:
(1)电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
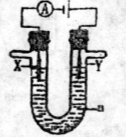
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中会生成白色固体,发生的总反应化学方程式为
。
该白色固体露置在空气中,可观察到的现象是
。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中电子转移的物质的量为 mol。高☆考♂资♀源*网
(2)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO??4溶液。
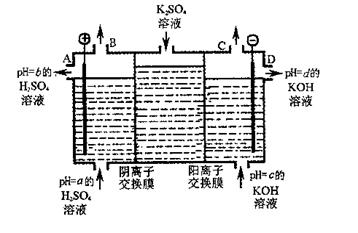
①该电解槽的阳极反应式为 ,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B口与C口产生气体的质量比为 。
查看答案和解析>>
科目: 来源: 题型:
密度为1.45 g/cm3的硫酸中,逐渐滴入BaCl2溶液直到沉淀完全为止,测得沉淀质量与原硫酸溶液质量相等,则原硫酸溶液物质的量浓度为 ( )
A.6.22 mol/L B.12.22 mol/L C.15.8 mol/L D.16.8 mol/L
查看答案和解析>>
科目: 来源: 题型:
据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能给合质子的分子或离子都是碱,按照这种理论下列物质既属于酸又属于碱的是( )
A.NaCl B.H2O C.NaHSO4 D.Al2O3
查看答案和解析>>
科目: 来源: 题型:
下面关于多电子原子核外电子的运动规律的叙述正确的是( )
A.核外电子是分层运动的
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.能量高的电子在离核近的区域绕核旋转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com