
科目: 来源: 题型:
下列实验操作中所用仪器合理的是 ( )
A.用 10 mL 量筒量取 5.2 mL 盐酸
B.用 100 mL 量筒量取 5.2 mL 盐酸
C.用托盘天平称取 25.02 g NaCl
D.用 100 mL 容量瓶配制 50 mL 0.1 mol/L 的盐酸
查看答案和解析>>
科目: 来源: 题型:
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的先后离子方程式是 ( )
①CO2+OH-=HCO3- ②CO2+2OH- =CO32-+ H2O ③CO32-+Ba2+=BaCO3↓
④ BaCO3+CO2+H2O=Ba2++2HCO3- ⑤CO32-+CO2+H2O=2HCO3-
A.②⑤ B.⑤④ C.④② D.④①
查看答案和解析>>
科目: 来源: 题型:
(分)下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | / | +3 | +4 | +5 | +7 | +1 | +5 | / |
| 最低价态 | / | / | -2 | / | -4 | -3 | -1 | / | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(填写编号) 。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
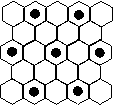
(3)元素⑤的某种单质具有平面层状结构,同一层中 的原子构成许许多多的正六边形,此单质与熔融的② 单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
某反应的化学方程式为:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,若b=1,d=3,则X的化学式为 ( )
A.N2 B.NO C.NO2 D.NH4Cl
查看答案和解析>>
科目: 来源: 题型:
关于下图所示的原电池,下列说法正确的是 ( )
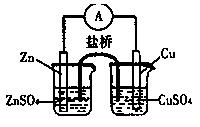
A.电子从铜电极通过检流计流向锌电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是![]()
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,使CO和![]() 的混合气体26g充分反应,所得混合物在常温下跟足量的
的混合气体26g充分反应,所得混合物在常温下跟足量的![]() 固体反应,结果固体增重14g,则原混合气体中
固体反应,结果固体增重14g,则原混合气体中![]() 和CO的质量比可能是( )
和CO的质量比可能是( )
A.9:4 B.1:1 C.7:6. D.6:7
查看答案和解析>>
科目: 来源: 题型:
在恒温条件下,向CH3COONa稀溶液中分别加入少量下列物质:其中可使比值
c(CH3COO-)/c(Na+)增大的是
A. 固体NaOH B固体KOH.
C. 相同浓度的 CH3COONa稀溶液 D. 氯化钠固体
查看答案和解析>>
科目: 来源: 题型:
1943年,侯德榜先生研究成功了联合制碱法,该方法不仅提高了食盐的利用率,还在
得到纯碱的同时获得了重要的副产品氯化铵。下列关于Na2CO3溶液和NH4Cl溶液的说法正确的是 ( )
A.适当升温,两溶液的pH均增大
B.常温下pH=10的碳酸钠溶液与pH=4的氯化铵溶液中水的电离程度相同
C.0.1 mol/L Na2CO3溶液中c(Na+)=c(CO32—)+c(HCO—3)+C(OH—)
D.0.l mol/L NH4C1溶液.中c(C1-)>c(NH4+)>c(OH—)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
根据下列实验事实,得出的结论正确的是 ( )
![]()
A.气体 品红溶液褪色
结论:原气体一定是SO2
B.气体A 气体B 白色沉淀
结论:原气体一定是烃
C.某溶液 冒白雾 白烟
结论:原溶液一定是浓盐酸
D.某溶液 血红色
结论:原溶液中一定含有Fe3+
查看答案和解析>>
科目: 来源: 题型:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的NaOH溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______ _________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图示,则所用盐酸溶液的体积为___ _____ mL。

(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________。
A.酸式滴定管未用标准液润洗就直接注入标准盐酸溶液
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请用上述数据计算该NaOH溶液的物质的量浓度。c(NaOH)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com