
科目: 来源: 题型:
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)![]() 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:

反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度升高,
K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
查看答案和解析>>
科目: 来源: 题型:
为了测定酸碱反应的中和热,计算时至少需要的数据是:①酸的浓度和体积;②
碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后温度变化;⑦操作所需的时间
A.①②③⑥ B.①③④⑤ C.③④⑤⑥ D.全部
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式正确的是
A.少量金属钠放入冷水中:Na+ 2H2O = Na++2OH-+H2↑
B. Cl2与水反应:Cl2+ H2O = H+ + Cl- + ClO-
C. 氢氧化钙溶液与碳酸氢镁溶液反应:
Mg2+ +2HCO3-+ Ca2++ 2OH-=CaCO3↓+ MgCO3↓+2H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3?? =3Fe3++NO↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
近几年一种新型的甜味剂——木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防龋齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是
A.木糖醇与葡萄糖、果糖等一样是属于多羟基醛或酮,是一种单糖
B.已知木糖醇的溶解度随着温度升高而增大,说明木糖醇的溶解过程是一个吸热过程
C.木糖醇是一种五元醇
D.木糖醇是一种无糖型植物甜味剂
查看答案和解析>>
科目: 来源: 题型:
(1)相同质量的臭氧(O3)和氧气(O2)所含的分子数之比是__________,所含原子数目之比是__________,在标准状况下所占的气体体积比是____________。
(2)在2KMnO4 + 16HCl=2KCl +2MnCl2 + 5Cl2↑+ 8H2O反应中,若被氧化的HCl是0.4mol,则反应生成_________克氯气,转移的电子数是_______________个。
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况 。
②漂白粉的有效成分是(填化学式) 。
查看答案和解析>>
科目: 来源: 题型:
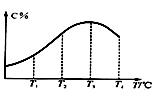
有可逆反应A(g)+B(g) ![]() 2C(g),在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。填写下列空白:
2C(g),在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。填写下列空白:
⑴反应在 温度下达到平衡。 ⑵正反应为 热反应(填“放”或“吸”)。 ⑶由T3向T4变化时,v正 v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
在一个绝热的固定容积的密闭容器中发生可逆反应:(g) + 3(g) ![]() 2(g);
2(g);
△H<0,下列各项中不能说明该反应已经达到平衡状态的是
A.体系的压强不再改变
B.体系的温度不再改变
C.消耗1mol的同时,新生成3mol
D.反应消耗的 、与产生的的速率υ():υ():υ() == 1 : 3 : 2
查看答案和解析>>
科目: 来源: 题型:
已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
A.该反应显示硫酸具有酸性
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.反应中硫酸作氧化剂
查看答案和解析>>
科目: 来源: 题型:
有一处于平衡状态的反应X(g)+3Y(g)![]() 2Z(g) △H<0,为了使平衡向生成Z的方向移动,应选择的条件是①高温 ②低温 ③高压 ④低压 ⑤加催化剂⑥分离出Z
2Z(g) △H<0,为了使平衡向生成Z的方向移动,应选择的条件是①高温 ②低温 ③高压 ④低压 ⑤加催化剂⑥分离出Z
A.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥
查看答案和解析>>
科目: 来源: 题型:
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
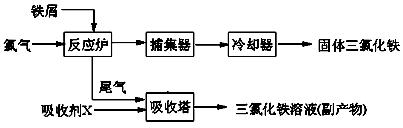
(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com