
科目: 来源: 题型:
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是 16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+H2SO4(80%) ![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
【注:80%H2SO4具有浓硫酸的特性】
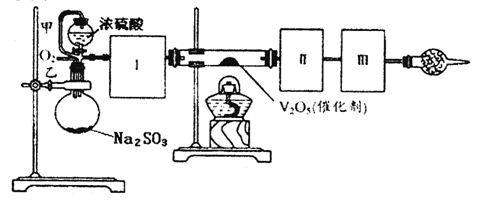
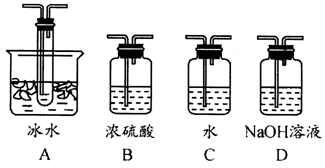
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~D装置中选择最合适的装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是___________、_____________、_____________。
(2)在实验中“加热催化剂”与“滴加浓硫酸”的操作,首先应采取的操作是___________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法。
①原因__________________________________________________.
验证方法________________________________________________.
②原因__________________________________________________.
验证方法________________________________________________.
(4)将足量SO2通入含1.0mol次氯酸的溶液中,有1.204×1024个电子转移,生成两种强酸,该反应的化学方程式为______________________________。
(5)用25.2gNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间将反应产生的SO2全部排出,测得装置Ⅲ增重了3.2g,则SO2的转化率为__________。
查看答案和解析>>
科目: 来源: 题型:
一定温度下,在固定体积的密闭容器中进行反应:N2+3H2![]() 2NH3。该反应达到平衡的标志是
2NH3。该反应达到平衡的标志是
A.3v(H2)正=2v(NH3)逆 B.单位时间生成m mol N2的同时生成3m mol H2
C.混合气体的密度不再随时间变化 D.容器内的总压强不再随时间而变化
查看答案和解析>>
科目: 来源: 题型:
硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI ![]() H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
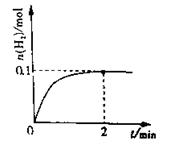
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.2010年诺贝尔化学奖授予“钯催化交叉偶联反应”的研究,采用钯催化可将碳原子连接在一起制造新的有机材料,所以钯催化剂能催化所有类型的有机反应。
B.把CO中毒的病人放入高压氧仓中解毒,其原理符合勒夏特列原理
C.日常生活中无水乙醇常用于杀菌消毒
D.“绿色荧光蛋白质”是不可降解的高分子化合物,其水溶液有丁达尔效应
查看答案和解析>>
科目: 来源: 题型:
下列叙述的方法不正确的是
A. 金属的电化学腐蚀比化学腐蚀更普遍
B. 用铝质铆钉铆接铁板,铁板易被腐蚀
C. 钢铁在干燥空气中不易被腐蚀
D. 用牺牲锌块的方法来保护船身
查看答案和解析>>
科目: 来源: 题型:
甲、乙两种非金属:①甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;②甲比乙更容易与氢气化合;③甲单质能与乙阴离子发生氧化还原反应;④与金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说明甲比乙的非金属性强的是
A、①②③④ B、①②③④⑤ C、①②③ D、②③④⑤
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是
A.共价化合物中一定只含有极性共价键
B.只含有共价键的物质一定是共价化合物
C.离子化合物中可能含有极性共价键或非极性共价键
D.有较强共价键存在的物质熔沸点一定很高
查看答案和解析>>
科目: 来源: 题型:
关于离子键、共价键的各种叙述中,下列说法中正确的是
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
D.由不同元素组成的含多个原子的分子里,一定只存在极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com