
科目: 来源: 题型:
下列关于元素周期表和元素周期律的说法错误的是( )
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐减弱
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
科目: 来源: 题型:
下列反应属于加成反应的是( )
A.乙烯使酸性高锰酸钾溶液褪色 B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使溴水褪色 D.甲烷与氯气混合光照一段时间后黄绿色消失
查看答案和解析>>
科目: 来源: 题型:
(物质结构与性质)有A、B、C、D、E、F 6种元素,B原子得到一个电子后3p轨道全充满,A+比B形成的简单离子少一个电子层;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价和最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数为26。请回答下列问题:
(1)A元素位于元素周期表中第_________周期第__________族;;F元素基态原子形成的+3价阳离子的电子排布式为___________。
(2)C与B形成的CB3分子中C原子的杂化方式是____________,其分子的空间构型是____________
(3)另一元素X与A同主族,第一电离能小于A,晶体XB与AB中熔点较高的是 _____________,其理由是______________________
(4)1mol ED晶体中含有的E—D键的数目是____________。
查看答案和解析>>
科目: 来源: 题型:
重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入 (填字母序号),沉淀效果最好。
A. NaOH B. Na2S C. KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。
(3)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)= ,是否符合排放标准 (填“是”或“否”)。已知KSP(AgCl)=1.8×10-10mol2·L-2。
查看答案和解析>>
科目: 来源: 题型:
下列对相关实验操作的说法中,一定正确的是
A.酸碱中和滴定实验中只能用标准液滴定待测液
B.测定硫酸铜晶体中结晶水含量时必须进行恒重操作
C.实验室配制480 mL 0.1 mol/L NaOH溶液,需要准确称量NaOH 1.920 g
D.分液时,分液漏斗中下层液体从下口放出后,换一容器再从下口放出上层液体
查看答案和解析>>
科目: 来源: 题型:
15
Ⅰ醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。
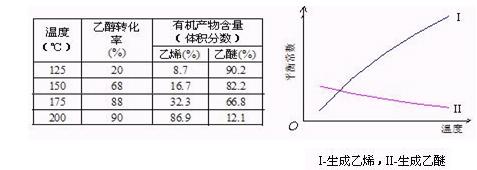
已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃。试分析:
(1)乙醇脱水制乙烯的反应是 (填“放热”、“吸热”)反应,若增大压强,平衡 (选填 “正向”、“逆向”、“不”)移动。
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式K= 。
当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号)。
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(3)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量 (选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是 。
Ⅱ水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3 ,而后用酸去除。从CaSO4到CaCO3的沉淀转化中,并存在着两个沉淀溶解平衡,
写出前一个沉淀溶解平衡表达式:
已知Ksp(CaCO3) =2.8×10-9 mol2/L2 ,将136gCaSO4固体加入1L Na2CO3溶液中,待沉淀转化后,溶液中c(CO32-) = 0.001mol/L。计算Ksp(CaSO4) = mol2/L2
(忽略溶液体积变化)
查看答案和解析>>
科目: 来源: 题型:
已知Ba(AlO2)2可溶于水。下图表示的是向100 mL 0.02 mol·L-1 KAl(SO4)2溶液中逐滴加入0.05 mol·L-1 Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系。下列说法不正确的是
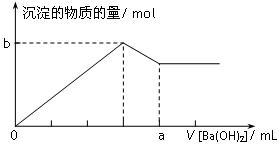
A.所加的Ba(OH)2溶液的pH=13
B.a点的值是80 mL
C.b点的值是0.005 mol
D.当V [Ba(OH)2]=30 mL时,生成沉淀的质量是0.699 g
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是( )
A.液晶是由分子较大、分子形状呈长形或碟形的物质形成的晶体
B.制造光导纤维的主要材料是高纯度硅,属于原子晶体
C.H2O分子比H2S分子稳定是因为水分子之间存在氢键
D.NaCl和MgO晶体熔融时克服的作用力相同
查看答案和解析>>
科目: 来源: 题型:
已知298K时,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q kJ·mol-1.在相同条件下,向密闭容器中加入1 molN2和3 molH2,达到平衡时生成0.2molNH3放出的热量为Q1 kJ,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2 kJ,若向相同容积的另一密闭容器中通入2molNH3,达到平衡时吸收的热量为Q3kJ。则下列关系式正确的是:
2NH3(g) ΔH=-Q kJ·mol-1.在相同条件下,向密闭容器中加入1 molN2和3 molH2,达到平衡时生成0.2molNH3放出的热量为Q1 kJ,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2 kJ,若向相同容积的另一密闭容器中通入2molNH3,达到平衡时吸收的热量为Q3kJ。则下列关系式正确的是:
A.Q>Q1>Q2>Q3 B.Q= Q1+ Q3 C.Q>Q1+ Q3 D.Q>Q3>Q1>Q2
查看答案和解析>>
科目: 来源: 题型:
有机物A为绿色荧光蛋白在一定条件下水解的最终产物之一,结构简式为: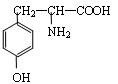
请回答下列问题:
(1)A的分子式为 。
(2)A与氢氧化钠溶液反应的化学方程式为 。
(3)已知:

两个A分子在一定条件下生成的化合物结构简式为 。
(4)符合下列4个条件的同分异构体有6种,写出其中三种 。
①1,3,5-三取代苯
②遇氯化铁溶液发生显色反应
③氨基与苯环直接相连
④属于酯类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com