
科目: 来源: 题型:
用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的 HCl.反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)15.8g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl 2在标准状况下的密度为3.17g/L,则产生的Cl 2在标准状况下的体积为多少?
查看答案和解析>>
科目: 来源: 题型:
维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行测定。该反应的化学方程式如下:C6H8O6+I2 C6H6O6+2HI,现欲测定某样品中维生素C的含量,具体的步骤及测得的数据如下。取10 mL 6 mol/L CH3COOH,加入100 mL蒸馏水,将溶液加热煮沸后放置冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中。加入1 mL淀粉指示剂,立即用浓度为0.05000 mol/L的I2溶液进行滴定,直至溶液中的蓝色持续不褪为止,共消耗21.00 mL I2溶液。
(1)为何加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用?
(2)计算样品中维生素C的质量分数。
查看答案和解析>>
科目: 来源: 题型:
向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是 ( )
A.碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O
B.硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓
C.氢氧化铜和硫酸反应 OH-+H+=H2O
D.铁钉放入硫酸铜溶液中 Fe+3Cu2+=2Fe3++3Cu
查看答案和解析>>
科目: 来源: 题型:
下列哪种情况能使下图装置中的溶液导电性呈现“强-弱-强”变化的是 ( )
A.将50mL 0.1mol/L的H2SO4溶液慢慢加入50mL 0.1mol/L的Ba(OH)2溶液中; B.将50mL 0.1mol/L的NaCl溶液慢慢加入50mL 0.1mol/L的AgNO3溶液中
C.在50mL 饱和澄清石灰水中通入CO2直至过量
D.在50mL 0.1mol/L的CH3COOH溶液中慢慢加入50mL 0.1mol/L的NaOH溶液

查看答案和解析>>
科目: 来源: 题型:
下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
查看答案和解析>>
科目: 来源: 题型:
北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
mg/kg。
查看答案和解析>>
科目: 来源: 题型:
已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量
下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
查看答案和解析>>
科目: 来源: 题型:
下图中的A、B、C、D、E、F、G均为有机物
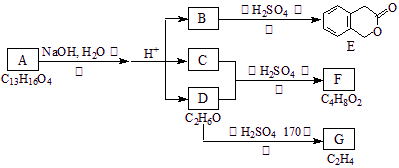
据上图回答问题:
(1)D的化学名称是 。
(2)反应③的化学方程式是: (有机物须用结构简式表示)
(3)B的分子式是:
A的结构简式是 反应的反应类型是
(4)符合下列3个条件的B的同分异构体的数目有 个
ⅰ)含有邻二取代苯环结构、 ⅱ)与B有相同官能团、ⅲ)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式
(5)G是的工业原料,用化学方程式表示G的一种的工业用途
查看答案和解析>>
科目: 来源: 题型:
下列变化能够实现的是 ( )
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
A.只有①③ B.只有②④ C.只有①②④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com