
科目: 来源: 题型:
如图所示,离地面足够高处有一竖直的空管,质量为2kg,管长为24m,M、N为空管的上、下两端,空管受到F=16N竖直向上的拉力作用,由静止开始竖直向下做加速运动,同时在M处一个大小不计的小球沿管的轴线以初速度v0竖直上抛,不计一切阻力,取g=10m/s2.求:
(1)若小球上抛的初速度为10m/s,经过多长时间从管的N端穿出?
(2)若此空管的N端距离地面64m高,欲使在空管到达地面时小球必须落到管内,在其他条件不变的前提下,求小球的初速度v0大小的范围.

查看答案和解析>>
科目: 来源: 题型:
下列关于氯的说法正确的是 ( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B. 35 17Cl、37 17Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.11.2LCl2含有17NA个质子(NA表示阿伏伽德罗常数)
查看答案和解析>>
科目: 来源: 题型:
以下与胶体性质无关的是
A.豆浆中加入盐卤做豆腐
B.用可见光束可以鉴别红褐色的氢氧化铁胶体和溴水
C.向FeCl3溶液中加入稀NaOH溶液出现红褐色沉淀
D.肾功能衰竭者常用的血液透析治疗法
查看答案和解析>>
科目: 来源: 题型:
已知KMnO4和H2C2O4在酸性溶液中发生反应:
KMnO4+ H2C2O4+ H2SO4 — K2SO4+ MnSO4+ CO2↑+ H2O(请配平)。
甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小,实验装置如图所示。
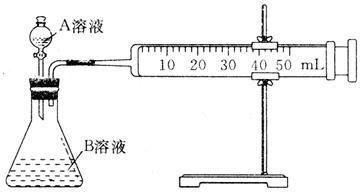
实验时A溶液一次性放下,A,B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ③ | 2mL 0.2 mol·L-1L H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液、少量催化剂 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2![]() 0.1
0.1![]() H2C2O4溶液,另取两支试管各加入4
H2C2O4溶液,另取两支试管各加入4![]() 0.1
0.1![]() KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
查看答案和解析>>
科目: 来源: 题型:
能够鉴定1—氯丙烷中存在氯元素的操作是
A.在1—氯丙烷中直接加入AgNO3溶液
B.将1—氯丙烷溶于水,然后加入AgNO3溶液
C.在1—氯丙烷中加入NaOH溶液,加热再用硝酸酸化,然后加入AgNO3溶液
D.在1—氯丙烷中加入乙醇,加热再用盐酸酸化,然后加入AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A. H2O2 B. IO3- C. MnO4- D. HNO3
查看答案和解析>>
科目: 来源: 题型:
 16.某实验小组对一含有Al3+的未知溶液进行了如下分析:①滴入少量氢氧化钠溶液,无明显变化;②继续滴加氢氧化钠溶液,开始产生白色沉淀;③滴入过量的氢氧化钠溶液,白色沉淀明显减少。实验小组经定量分析,绘出沉淀的物质的量与滴入氢氧化钠体积的关系图:
16.某实验小组对一含有Al3+的未知溶液进行了如下分析:①滴入少量氢氧化钠溶液,无明显变化;②继续滴加氢氧化钠溶液,开始产生白色沉淀;③滴入过量的氢氧化钠溶液,白色沉淀明显减少。实验小组经定量分析,绘出沉淀的物质的量与滴入氢氧化钠体积的关系图:
则下列说法中错误的是( )
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5![]()
C.若另一种离子为二价阳离子,则a=10
D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6g
查看答案和解析>>
科目: 来源: 题型:
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。

(1)M的离子结构示意图为___ __;元素T周期表中位于第__ _ _族。
(2)J和氢组成的化合物分子有4个原子,其结构式为____ __。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为___ __。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为_ __ ___。
②由甲与氧气、KOH 溶液构成原电池,负极会产生L的单质。则其负极反应式为__________________________ ____。
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为____ ____。
查看答案和解析>>
科目: 来源: 题型:
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
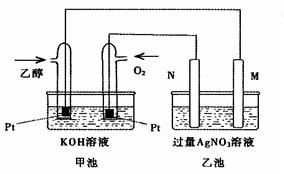
(1)M电极的材料是 ,电极名称是 ,N的电极反应式为 ,加入乙醇的铂电极的电极反应式 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为 。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com