
科目: 来源: 题型:
1体积某气态烃只能与1体积氯气发生加成反应,生成氯代烷。1 mol此氯代烷可与6 mol氯气发生完全的取代反应,则该烃的结构简式为:
A.CH3CH=CH2 B.CH2=CH2
C.CH3CH3 D.CH3CH2CH=CH2[
查看答案和解析>>
科目: 来源: 题型:
制取硝酸铜的以下三种方案的叙述中,不正确的是
①2Cu+O2![]() 2CuO,CuO+2HNO3== Cu(NO3)2 + H2O
2CuO,CuO+2HNO3== Cu(NO3)2 + H2O
②3Cu+8HNO3(稀)![]() 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
③Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
A.三种方案中所涉及的反应都属于氧化还原反应
B.三种方案中硝酸的利用率:②>①>③
C.制取相同量的硝酸铜,②产生的有害气体比③多
D.三种方案中,①方案最优
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是(NA表示阿伏加德罗常数的数值)
A.71g氯气含有的原子数目为NA
B.4 g金属钙变成钙离子时失去的电子数目为0.1NA
C.标准状况下,22.4LH2O中含有的分子数为NA
D.在标准状况下,22.4 L甲烷与乙炔的混合物所含分子数为NA
查看答案和解析>>
科目: 来源: 题型:
溴水和氯化铁溶液均是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。在探究铁的化合物相互转化时,进行下列实验。
实验操作:向足量20 mL的FeSO4溶液中,滴入几滴浓溴水,振荡。
实验现象:溶液由浅绿色变成黄色。
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是 (填化学式,下同);
②如果未发生化学反应,则使溶液呈黄色的微粒是 。
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应。下列是设计的一些实验方案和预测。请填空:
| 操作 | 预期现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH溶液 | 如果生成红褐色沉淀,则说明发生了反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 如果溶液变蓝色,则说明未发生反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 如果下层溶液呈橙红色,则说明:
|
①方案1是否合理? (填“合理”或“不合理”)。
方案2中,由于存在反应 (用离子方程式表示),所以预测结论不正确。
②请你另外设计一个合理方案,证明已经反应。将有关内容填入下表。
| 实验操作 | 预期现象及结论 | 解释现象的离子方程式 |
查看答案和解析>>
科目: 来源: 题型:
偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是
A.偏二甲肼(C2H8N2)的摩尔质量为60g/mol
B.6.02×1023个偏二甲肼(C2H8N2)分子的质量与其摩尔质量相等
C.1 mol 偏二甲肼(C2H8N2)中共含有12 mol原子
D.6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
查看答案和解析>>
科目: 来源: 题型:
三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用。则下列有关说法中不正确的是
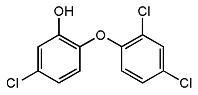
A.物质的分子式为C12H6Cl3O2
B.该物质与FeCl3溶液混合后可显色
C.该物质中所有原子一定处于同一平面
D.该物质苯环上的一溴取代物有6种
查看答案和解析>>
科目: 来源: 题型:
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式:2NO+2CO ![]() 2CO2+N2;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应是________ 反应(填写“吸热”、“放热”)。
(2)前2s内的平均反应速度v(N2)=________。
(3)此反应的平衡常数表达式为K=________。
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
查看答案和解析>>
科目: 来源: 题型:
高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为:
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下:

(1)写出反应①的离子方程式_____________________________。
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4) _________ Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。

①工业生产中最佳温度为_______℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为_______。
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
____________________________________________________。
若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____________________________________。
(4)K2FeO4 在水溶液中易水解:4FeO42—+10H2O![]() 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______溶液(填序号)。
A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com