
科目: 来源: 题型:
下列有关金属腐蚀与防护的说法正确的是
A.合金中有两种或两种以上金属,容易形成原电池,因此合金一定比相应的金属单质更易被腐蚀
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
科目: 来源: 题型:
配制0.1mol/L的NaOH溶液,下列哪些操作会使实验结果偏高 ( )
A.用滤纸称量NaOH固体 B.移液前容量瓶内有水珠
C.摇匀后,液面低于刻度线,再加水至刻度线
D.定容时,俯视刻度线
查看答案和解析>>
科目: 来源: 题型:
科学家P.Tatapudi等人首先使用在空气中电解水(酸性条件下)的方法在阳极制得臭氧,阴极制得过氧化氢。电解总方程式为:3H2O+3O2 3H2O2+O3,下列说法正确的是
A.电解产物在应用中都只能作为氧化剂 B.电解一段时间后,溶液pH不变
C.每生成1 mol O3转移电子数为3 mol D.阳极的反应:3H2O→O3+6H++6e-
查看答案和解析>>
科目: 来源: 题型:
已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列叙述中,正确的是
A. Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2==2FeCl3+4FeI3
B. 每1 mol Co2O3在酸性溶液中被氧化生成Co2+时转移2 mol e-
C. FeCl3溶液能使淀粉—KI试纸变蓝
D. I2是ⅦA族元素单质,具有较强的氧化性,可以将Co2+氧化成Co2O3
查看答案和解析>>
科目: 来源: 题型:
某种兴奋剂的结构简式如图所示,有关该物质的说法中不正确的是
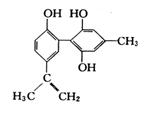
A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 该物质能使酸性KMnO4溶液褪色
C. 该物质能与浓溴水发生加成反应和取代反应
D. 1 mol 该物质在催化剂作用下最多能与7 mol H2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
除去下列物质中少量杂质的方法正确的是
A.除去CO2中混有的HCl:用饱和碳酸钠溶液洗气
B.除去NO2中混有的NO:用水洗气
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
查看答案和解析>>
科目: 来源: 题型:
如图为元素周期表的一部分。X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的7/8。则下列说法中正确的是:
![]()
A. Y单质可与Z的氢化物的水溶液反应,使溶液pH减小
B. 最高价氧化物的水化物酸性:W>Z
C. 原子半径由大到小的排列顺序是:Z>Y>X
D. X的单质中有一种为白色蜡状固体
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4︰1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2︰1的离子化合物丙。
⑴ D的原子结构示意图为 ,B单质的电子式为 ,E在周期表中的位置为 ;
⑵ 下列说法正确的有 ;
a.化合物乙为正四面体形分子,是由极性键构成的非极性分子
b.C、D、E、F原子半径由大到小的顺序为 C > D > E > F
c.B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
d.化合物甲和化合物丙都含有离子键和共价键
⑶ 将F在空气中完全燃烧的产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应:
;
⑷ 写出一个由以上元素构成的10 e- 微粒与18 e- 微粒反应的离子方程式:
;
⑸ 在1 mol·L-1 甲溶液中,下列关系式正确的是 ;
a.c(NO3-) > c(NH4+) > c(H+) > c(OH-)
b.c(NH4+) > c(NO3-) > c(H+) > c(OH-)
c.c(NO3-) = c(NH4+) > c(H+) = c(OH-)
d.c(NH4+) = c(NO3-) > c(H+) > c(OH-)
⑹ 25 ℃时,丙的水溶液的pH大于7,其原因是(用离子方程式解释):
。
查看答案和解析>>
科目: 来源: 题型:
下列反应达到平衡后,降压、升温能使化学平衡向逆反应方向移动的是
A.S(s)+O2(g) ![]() SO2(g) (正反应为放热反应)
SO2(g) (正反应为放热反应)
B.N2(g) + 3H2(g) ![]() 2NH3(g) (正反应为放热反应)
2NH3(g) (正反应为放热反应)
C.C(s)+ CO2(g) ![]() 2CO(g) (正反应为吸热反应)
2CO(g) (正反应为吸热反应)
D.H2(g) + I2(g) ![]() 2HI(g) (正反应为吸热反应)
2HI(g) (正反应为吸热反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com