
科目: 来源: 题型:
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有_________________(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_______(填“是”“否”“不能确定”)。
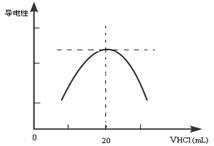 (3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
(3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。
写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+ 浓度下降,这样,恰好完全反应时NH4+ 浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
查看答案和解析>>
科目: 来源: 题型:
已知N2+3H2![]() 2NH3,根据下图判断:
2NH3,根据下图判断:
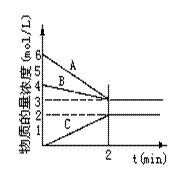 A是_____________的物质的量浓度变化情况。反应开始时,C(N2)=_____________ ;2min时C(NH3)=_____________________,
A是_____________的物质的量浓度变化情况。反应开始时,C(N2)=_____________ ;2min时C(NH3)=_____________________,
0-2min内氢气的平均反应速率v(H2)= ___________________。
(2)一定条件下,可逆反应A2+B2![]() 2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)=0.1mol/L C(C)= 1.6 mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)=0.1mol/L C(C)= 1.6 mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
①a、b应满足的关系是______________。
②a的取值范围是________,说明理由___________________________。
查看答案和解析>>
科目: 来源: 题型:
熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- → 34CO2+10H2O。试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
(1)AgNO3的水溶液常温时的pH 7(填“>”、“=”、“<”),原因是: ____________________ (用离子方程式表示);实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度.以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):
_____________________ ,
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
查看答案和解析>>
科目: 来源: 题型:
已知CO(g)十H2O(g) ![]() CO2(g)十H2 (g) △H<0 在850 ℃时,其平衡常数K=1,850 ℃时在该容器中同时充入1.0molCO,3.0molH2O,1.0molCO2,5.0molH2,根据所学知识可知
CO2(g)十H2 (g) △H<0 在850 ℃时,其平衡常数K=1,850 ℃时在该容器中同时充入1.0molCO,3.0molH2O,1.0molCO2,5.0molH2,根据所学知识可知
A. 此时反应向正反应方向进行
B. 平衡时CO2的物质的量为0.6mol
C.其他条件不变,向平衡后体系中加入1.0mol CO2,则平衡向左移动,K减小
D. 其他条件不变,向平衡后体系中再加入1.0molCO,3.0molH2O,1.0molCO2,5.0molH2,则平衡向左移动。
查看答案和解析>>
科目: 来源: 题型:
已知25℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl 水溶液中加入盐酸,Ksp值变大
B.AgNO3 溶液与NaCl 溶液混合后的溶液中,一定有c(Ag+)=c( Cl— )
C.温度一定时,当溶液中c(Ag+)×c( Cl— )=Ksp,此溶液为氯化银的饱和溶液
D 将固体AgCl 加入到较浓的KI 溶液中,部分AgCl会转化为AgI ,所以 AgCl的溶解度小于AgI
查看答案和解析>>
科目: 来源: 题型:
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A.该反应的化学平衡常数表达式是K=![]()
B.此时B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目: 来源: 题型:
在一密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,A的浓度变为原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,A的浓度变为原来的60%,则
A.平衡向正反应方向移动了 B.平衡向逆反应方向移动了
C.物质B的质量分数增加了 D.a<b
查看答案和解析>>
科目: 来源: 题型:
 常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1某一元弱酸HA溶液滴定曲线如右图。下列说法正确的是
常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1某一元弱酸HA溶液滴定曲线如右图。下列说法正确的是
A. 点①所示溶液中:
c(A-)+c(OH-) =c(HA) +c(H+)
B. 点②所示溶液中:
c(Na+) = c(HA) +c(A-)
C. 点③所示溶液中:
c(Na+) > c(A-)> c(OH-) > c(H+)
D. 滴定过程中可能出现:
c(HA) > c(A-) > c(H+) > c(OH-)> c(Na+)
查看答案和解析>>
科目: 来源: 题型:
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U形管)构成一个原电池(如右图)。以下有关该原电池的叙述正确的是
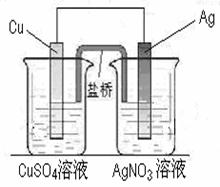 ①在外电路中,电子由铜电极流向银电极
①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③盐桥中K+移向CuSO4溶液
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
A.①② B.①②④
C.①②③ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com